ZASADA PAULIEGO
• Układ okresowy pierwiastków lub jakiekolwiek zestawienie danych fizyko-chemicznych pokazuje, ze właściwości tych pierwiastków powtarzają się cyklicznie w grupach 2, 8, 8, 18, 18, 32... -elementowych.
• Wolfgang Pauli (1900-1958) podał w 1925 roku zasadę (zwana też zakazem Pauliego), która „generuje” takie właśnie liczebności grup:
- na jednej orbicie mogą znajdować się nie więcej niż dwa elektrony, opisane tą samą falą stojącą (funkcją falową).
ZASADA PAULIEGO - c.d.
• Zasada Pauliego była wprowadzona empirycznie (bez dowodu ani uzasadnienia), ale dobrze wyjaśniała opisywaną liczebność grup (razem z istniejącą już kwantową teorią atomu i pojęciem liczb kwantowych):
dla
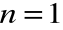
(główna liczna kwantowa) mamy jedną możliwość: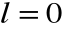
i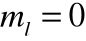
- czyli dwa elektrony;dla
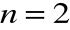
może być już: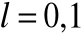
i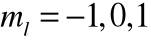
, co daje dokładnie cztery kombinacji: (2,0,0), (2,1,-1), (2,1,0) i (2,1,2) a więc zgodnie z zasadą Pauliego osiem elektronów;dla
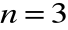
dochodzi pięć nowych kombinacji: (3,2,-2), (3,2,-1), (3,2,0), (3,2,1) i (3,2,2) co daje w sumie dziewięć kombinacji i osiemnaście funkcji elektronowych.
SPIN ELEKTRONU
• Zaledwie rok później odkryto, że wszystkie elektrony mają wewnętrzny (a więc nie związany z ruchem o orbicie wokół atomu) moment pędu równy:
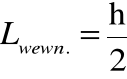
który nazwany został spinowym momentem pędu.
• Elektron zachowuje się więc jakby był wirującą kulką o ustalonym momencie pędu, równym połowie naturalnej jednostki momentu pędu ![]()
! Ten wewnętrzny moment pędu nie zwiększa się ani nie maleje.
Później okazało się również, że istnieją inne cząstki elementarne, których spin też równy jest ![]()
.
• P.M. Dirac i W. Pauli stworzyli po odkryciu spinu elektronu relatywistyczną teorię kwantową dla cząstek o spinie ½ i stwierdzili, że z warunków niezmienniczości wynikają funkcje falowe elektronów, które spełniają zasadę Pauliego - cząstka o takim spinie może mieć składowe momentu pędu wzdłuż osi ![]()
tylko równe ![]()
lub ![]()
- do opisu funkcji falowej elektronu doszła jeszcze jedna liczna kwantowa.
ATOMY WIELOELEKTRONOWE
• Równanie Schrödingera i zasada Pauliego stanowią podstawy teorii, dzięki której możemy przewidzieć właściwości pierwiastków bez przeprowadzania doświadczeń chemicznych!
• W praktyce często łatwiej jednak wykonać doświadczenie niż przeprowadzać żmudne i czasochłonne obliczenia komputerowe...
• Dla wodoru (liczba atomowa ![]()
) zgodnie z teorią jedyny elektron może przyjąć energię stanu kwantowego ![]()
, którego energia wynosi ![]()
- taka energia jest potrzebna by atom zjonizować, czyli wyrwać z niego ten jedyny elektron.
• Potencjał, odpowiadający wielkości energii, potrzebnej do zjonizowania atomu, nazywamy potencjałem jonizacji.
ATOMY WIELOELEKTRONOWE - c.d.1
• W atomie helu (![]()
), który ma dwa elektrony, również jądro ma ładunek ![]()
. Orbity elektronowe mają ten sam kształt, ale stałą proporcjonalności należy pomnożyć przez ![]()
.
atom helu z jednym elektronem (jednokrotnie zjonizowany) będzie więc miał energię jonizacji:
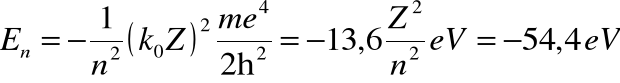
Tyle trzeba dostarczyć energii, żeby oderwać drugi elektron ze zjonizowanego atomu!
drugi elektron będzie najpierw „widział” obiekt o ładunku
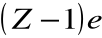
a dopiero po dostaniu się na powłokę
„zobaczy” cały ładunek jądra
- możemy więc założyć, że efektywny ładunek jądra, jaki „czują” elektrony w atomie helu jest średnią: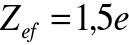
. Możemy więc uogólnić zależność na energię jonizacji:
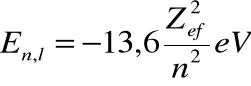
gdzie ![]()
zależy od obu liczb kwantowych ![]()
i ![]()
.
Z takiego szacowania otrzymujemy dla helu potencjał jonizacji (pierwszego elektronu) rzędu ![]()
. Dokładniejszy model daje wartość bardziej zbliżoną do wartości doświadczalnej: ![]()
.
ATOMY WIELOELEKTRONOWE - c.d.2
• W przypadku litu (![]()
), zgodnie z zasadą Pauliego, dwa elektrony obsadzą pierwszy orbital (powłokę) ![]()
a trzeci elektron musi znaleźć się już na orbitalu o głównej liczbie kwantowej ![]()
.
podwójnie zjonizowany atom litu zachowuje się jak atom wodoropodobny (jeden elektron „krążący” wokół jądra) ale energię jonizacji trzeba pomnożyć przez czynnik
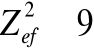
;jednokrotnie zjonizowany atom litu ma widmo podobne do widma atomu helu, ale
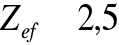
;trzeci elektron, znajdujący się na powłoce o wyższej energii (a więc również i większej średniej „odległości” od jądra) „widzi” efektywny ładunek jądra i dwóch poprzednich elektronów nieco większy od
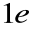
. Doświadczalnie wyznaczony potencjał jonizacji tego elektronu jest równy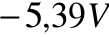
, co odpowiada ok.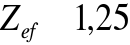
.
Aby dostać podwójnie zjonizowany atom litu, należałoby jeszcze oderwać drugi elektron, co wymagałaby potencjału ok. ![]()
- dlatego atom litu można w praktyce zjonizować tylko jednokrotnie.
ATOMY WIELOELEKTRONOWE - c.d.3
• Potencjał efektywny ![]()
zależy od obu liczb kwantowych, ![]()
i ![]()
co w praktyce powoduje, że dla atomów wieloelektronowych energia stanu o niższej liczbie głównej ![]()
ale wysokiej liczbie ![]()
może być większa, niż energia stanu o nieco wyższej (![]()
) głównej liczbie kwantowej, ale małej liczbie ![]()
(odpowiadającej za moment pędu elektronu na danej orbicie).
Przykład:
Dla potasu (![]()
) poziom (![]()
, ![]()
) leży niżej (tzn. ma niższą energię efektywną) niż poziom (![]()
, ![]()
). O tym potem...
• Interpretacja: kształt orbity o większym momencie pędu jest bardziej zbliżony do okręgu (sfery), co pociąga za sobą większą średnią odległość elektronu od jądra niż dla orbity o mniejszym momencie pędu (mniejszej liczbie kwantowej ![]()
). Dlatego stany o niższej orbitalnej licznie kwantowej ![]()
są stanami silniej związanymi.
ATOMY WIELOELEKTRONOWE - c.d.4
• Beryl (![]()
ma dwa elektrony (silnie związane, co już zrozumiałe) na pierwszej powłoce (![]()
), ale też dwa elektrony na drugiej (![]()
, ![]()
).
pierwszy potencjał jonizacji jest większy niż dla atomu litu, bo ładunek efektywny
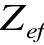
dla tej części funkcji falowej elektronu, która przebiega bliżej jądra, jest większy; wynosi on ok.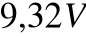
;drugi potencjał jonizacji nie jest jednak dużo większy, bo drugi elektron znajduje się w stanie
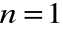
i „czuje” potencjał efektywny niewiele większy, niż pierwszy elektron;następne dwa potencjały jonizacji są bardzo duże, bo dwa „wewnętrzne” elektrony „widzą” dużo większy ładunek jądra.
Ze względu na to, że oba potencjały są tego samego rzędu, beryl wykazuje w związkach chemicznych wartościowość ![]()
(energia reakcji chemicznej „wystarczy” na podwójną jonizację).
ATOMY WIELOELEKTRONOWE - c.d.5
• Bor (![]()
), węgiel (![]()
), azot (![]()
), tlen (![]()
), fluor (![]()
) i neon (![]()
).
• Zapełniane są kolejno stany ![]()
powłoki ![]()
. Ponieważ dla ![]()
możliwe są trzy różne wartości ![]()
(poboczna liczba kwantowa), podpowłoka ta może „przyjąć” sześć elektronów.
• Podobna do poprzednio przeprowadzonej analiza przekonuje, że stosunkowo łatwo można zjonizować odpowiednio 3 (dla boru) 4 (dla węgla) i 5 (dla azotu) elektrony (dwa z poprzedniej podpowłoki ![]()
i pozostałe z tej o ![]()
).
• Proces zwany hybrydyzacją powoduje zresztą, że wszystkie 3 atomy dla boru i 4 dla węgla grają podobną rolę w procesie tworzenia związku chemicznego).
• Dla atomu azotu okazuje się, że energia jonizacji wszystkich pięciu elektronów tej podpowłoki jest porównywalna z energią, potrzebną do przyłączenia trzech atomów (więcej nie można w myśl zakazu Pauliego!)...
ATOMY WIELOELEKTRONOWE - c.d.5
• W przypadku tlenu i fluoru występuje nowe zjawisko, zwane powinowactwem elektronowym - zdecydowanie mniejszej energii potrzeba do przyłączenia kolejnych elektronów (jednego dla fluoru, dwóch dla tlenu) niż zjonizowanie wszystkich z całej podpowłoki.
Np. dla fluoru energia wiązania tego dodatkowego elektronu to tylko ![]()
. Dla tlenu energia wiązania pojedynczego „dołączonego” elektronu wynosi ok. ![]()
.
• W neonie wszystkie stany powłoki ![]()
są zapełnione - nie da się dołączyć już żadnego elektronu (dołączenie na wyższą, do tej pory ”gołą”, powłokę wymaga wielkiej energii) a jonizacja takiej „pełnej” powłoki też byłaby duża (ok. ![]()
), więc neon jest równie nieaktywny chemicznie jak hel.
• Od sodu (![]()
) do argonu (![]()
) sytuacja się powtarza: ![]()
, ![]()
równe najpierw ![]()
(dwa elektrony), potem ![]()
(sześć elektronów, bo teraz jeszcze ![]()
), podobne zasady obsadzania podpowłok i wartości energii jonizacji.
ATOMY WIELOELEKTRONOWE - c.d.6
• Jak już wspomniano, potencjał efektywny ![]()
zależy od obu liczb kwantowych ![]()
i ![]()
co powoduje w szczególności, że dla wyższych liczb orbitalnych ![]()
może się zdarzyć, że potencjały te są „przestawione” w szeregu wartości. Dla potasu (![]()
) jest właśnie tak, że potencjał efektywny podpoziomu (![]()
, ![]()
) jest większy niż potencjał dla podpoziomu (![]()
, ![]()
), co daje w wyniku mniejszą energię wiązania elektronu na podpowłoce (![]()
, ![]()
)! Powoduje to, że w potasie ( i następnym wapniu) najpierw zapełniana jest (dwa kolejne elektrony) podpowłoka (![]()
, ![]()
), a dopiero potem (![]()
, ![]()
).
• Począwszy od skandu (![]()
) nastąpi teraz obsadzanie kolejnych dziesięciu stanów podpoziomu (![]()
, ![]()
) (dziesięć elektronów, jako że teraz ![]()
) a później sześciu stanów podpoziomu (![]()
, ![]()
). Całkowita liczba stanów elektronowych o zbliżonych energiach jest więc równa:
![]()
i stąd bierze się liczba 18 w szeregu własności atomów.
ATOMY WIELOELEKTRONOWE - c.d.7
• Można w ten sposób wyznaczyć kolejne potencjały jonizacji i poziomy energetyczne a także powinowactwa elektronowe atomów za pomocą komputera. I choć wymaga to olbrzymiej ilości obliczeń - całą chemię można wyjaśnić za pomocą mechaniki kwantowej elektronu o spinie ½!
• Należy zwrócić uwagę na szczególnie duże przerwy energetyczne następujące po zapełnieniu powłok 2, 10, 18, 36, 54 i 86-ma elektronami - elektrony są wtedy mocno związane i pierwiastki o takich konfiguracjach są mało aktywne chemicznie.
PROMIENIE X
• Dla atomów o dużej liczbie atomowej ![]()
energie wiązań zewnętrznych elektronów są niewielkie (mniejszy jest ładunek efektywny ![]()
„widziany” przez te elektrony ze względu na „ekranowanie” przez elektrony z niższych powłok, zwłaszcza te o ![]()
). Ale za to energie wiązań dwóch pierwszych elektronów na powłoce ![]()
są olbrzymie, rzędu ![]()
!
• Gdyby udało się jednak „wyrwać” taki elektron z powłoki, ewentualnemu spadkowi elektronu z zewnętrznej powłoki na zwolnione miejsce towarzyszyłaby emisja wysokoenergetycznego fotonu o długości fali rzędu pojedynczych angstremów (Å). Dokonuje się tego poprzez bombardowanie atomów strumieniem elektronów o energiach rzędu ![]()
.
• Takie promieniowanie elektronów powłoki K (wewnętrznej) nazywane jest promieniowaniem X i używane jest (ze względu na długość fali porównywalną z rozmiarami atomów) do badań struktury atomowej pierwiastków.
WIĄZANIA CZĄSTECZEK
• Opisano dotąd strukturę elektronową pojedynczych atomów. W przypadku cząsteczek struktury te są bardziej skomplikowane i można je wyjaśnić opisując zachowanie elektronów składowych atomów cząsteczki w polu ich wspólnego potencjału.
• W zależności od zachowania elektronów na ostatnich powłokach składowych atomów cząsteczki, możemy wyróżnić dwa rodzaje wiązań atomowych: jonowe i kowalencyjne.
• Wiązanie jonowe: zewnętrzny elektron jednego atomu, słabiej z nim związany niż odpowiednie elektrony ostatniej powłoki drugiego atomu, zostaje przez ten drugi atom „przywłaszczony”; tworzą się w ten sposób dwa jony oddziaływujące ze sobą elektrostatycznie, co daje trwałe wiązanie między tymi atomami;
Przykład: cząsteczka fluorku litu (LiF):
- Energia jonizacji litu równa jest 5,4 eV.
- Powinowactwo elektronowe fluoru równe jest 3,6 eV.
- Wypadkowa energia potrzebna do oderwania elektronu od atomu litu: 1,8 eV.
- Energia elektrostatyczna jest równa 1,8 eV dla odległości między atomami równej 8 Å - wtedy elektron „przeskakuje” z atomu litu do fluoru.
WIĄZANIA CZĄSTECZEK
• Wiązania kowalencyjne: (rozpowszechnione w cząsteczkach organicznych) polegają na „uwspólnieniu” elektronów z zewnętrznych powłok przez oba atomy, wiążące się ze sobą.
Wiązania kowalencyjne występują wtedy, gdy mamy do czynienia z pewną „symetrią” zagadnienia: łączą się dwa atomy tego samego pierwiastka (![]()
, ![]()
) albo cząstka ma środek symetrii (metan ![]()
). Odpowiednia funkcja falowa, opisująca takie „wspólne” elektrony daje wtedy mniejsze wartości energii.
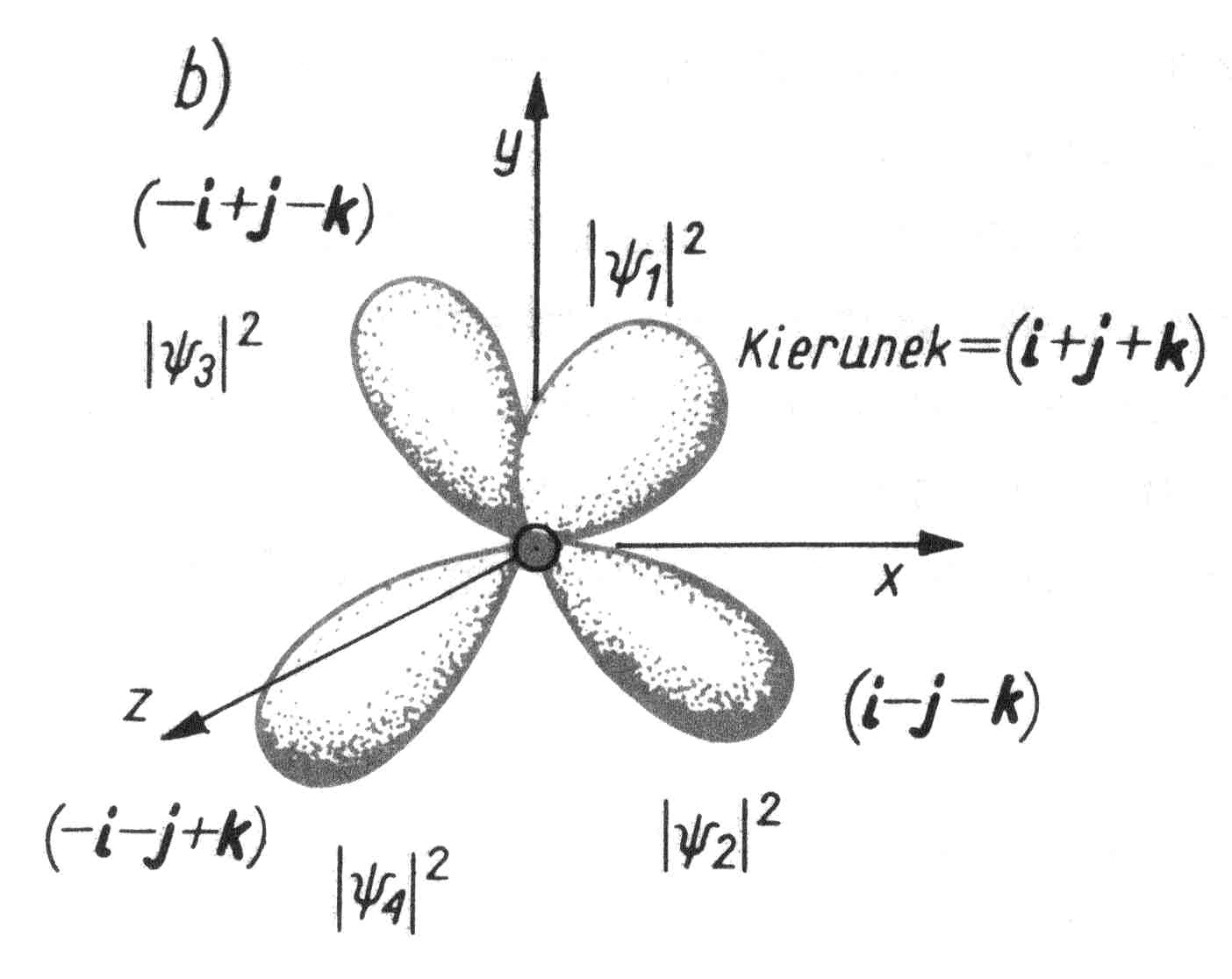
HYBRYDYZACJA
• W swobodnym atomie znajdują się na innych podpowłokach a więc mają inne energie, są inaczej związane z atomem (np. elektrony w stanie ![]()
są silniej związane niż te z podpowłoki ![]()
).
• W trakcie tworzenia cząsteczek atomy z poszczególnych podpowłok ostatniej powłoki traktowane są jednak równoważnie - jak pokazał przykład wiązania kowalencyjnego między atomem węgla (na powłoce ![]()
są dwa elektrony z ![]()
i dwa z ![]()
). Jest to wynikiem tego, że atomy wchodzące w skład cząsteczki nie są takie same, jak atomy izolowane.
• Rozwiązanie równania Schrödingera dla układu kilku jąder atomowych (skomplikowana funkcja, opisująca potencjał) nie jest łatwe, ale możliwe... Efekt zaprezentujmy na przykładzie omawianej cząstki metanu (![]()
).
HYBRYDYZACJA - c.d.1
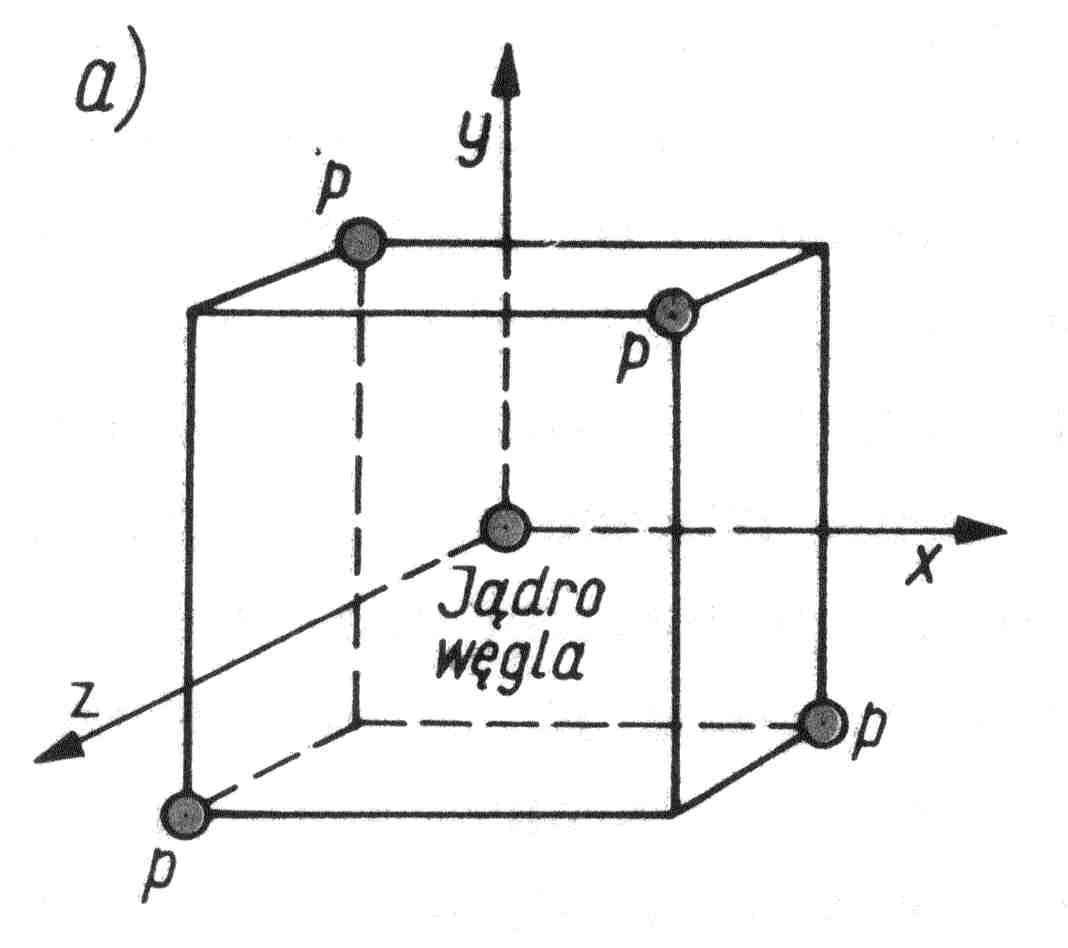
• Fale stojące, opisujące cztery zewnętrzne elektrony atomu węgla w takiej cząstce metanu, znacznie różnią się od rozwiązań dla atomu swobodnego, ale można je przedstawić w postaci sumy (kombinacji liniowej) funkcji atomu wodoropodobnego! Energie wiązania czterech zewnętrznych elektronów są jednakowe i równają się energii wiązania elektronu w stanie ![]()
.
• Rzeczywiście, funkcje falowe tych elektronów można zapisać jako superpozycje funkcji falowych elektronów atomu wodoropodobnego:
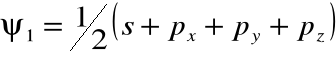
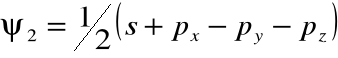
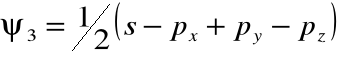
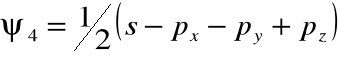
gdzie:
![]()
; 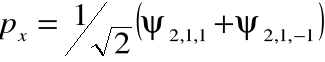
;
![]()
; 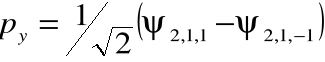
;
HYBRYDYZACJA - c.d.2
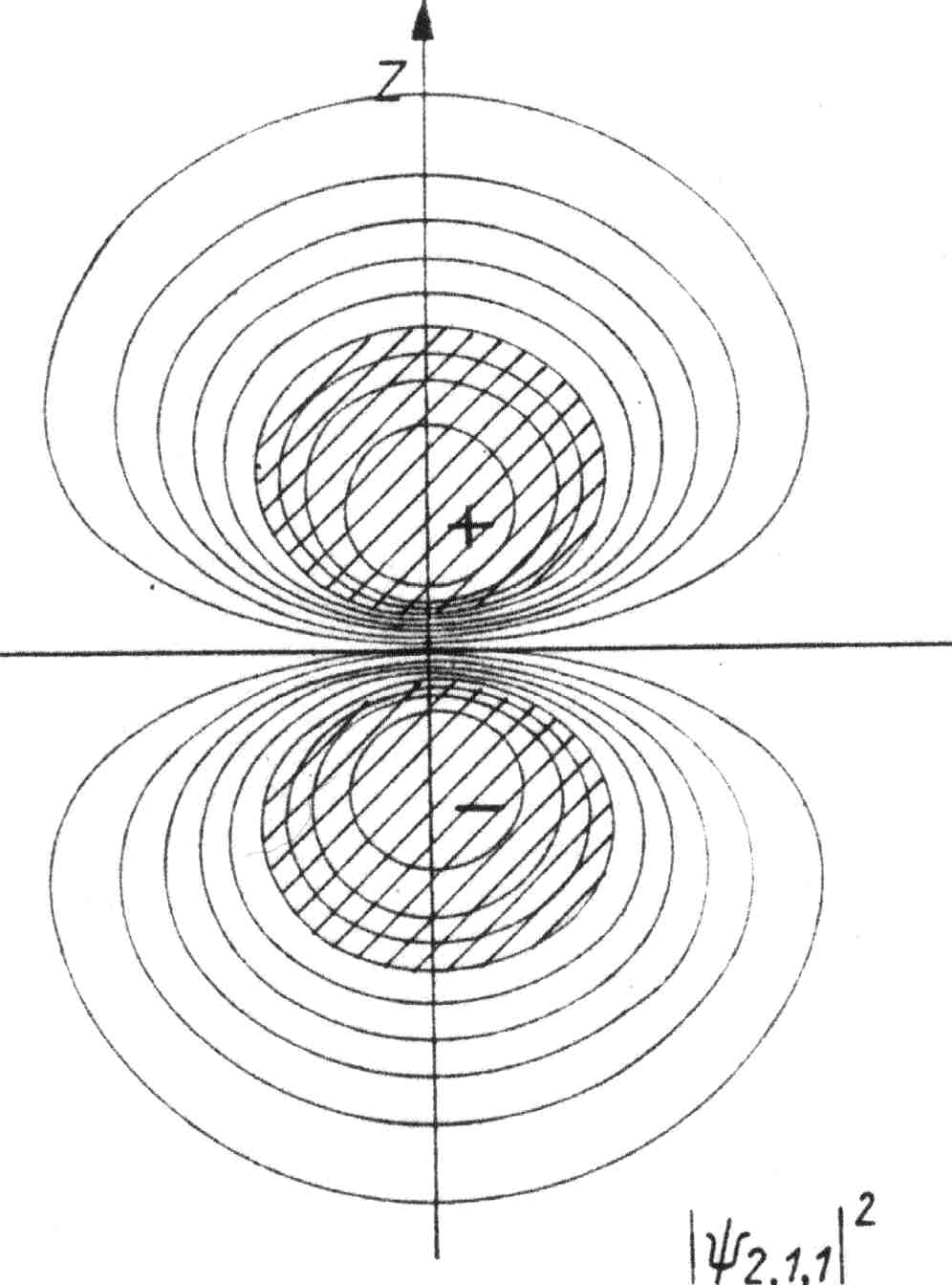
• Tak utworzone funkcje falowe są mocno niesymetryczne, „rozciągnięte” w jednym kierunku (np. osi ![]()
).
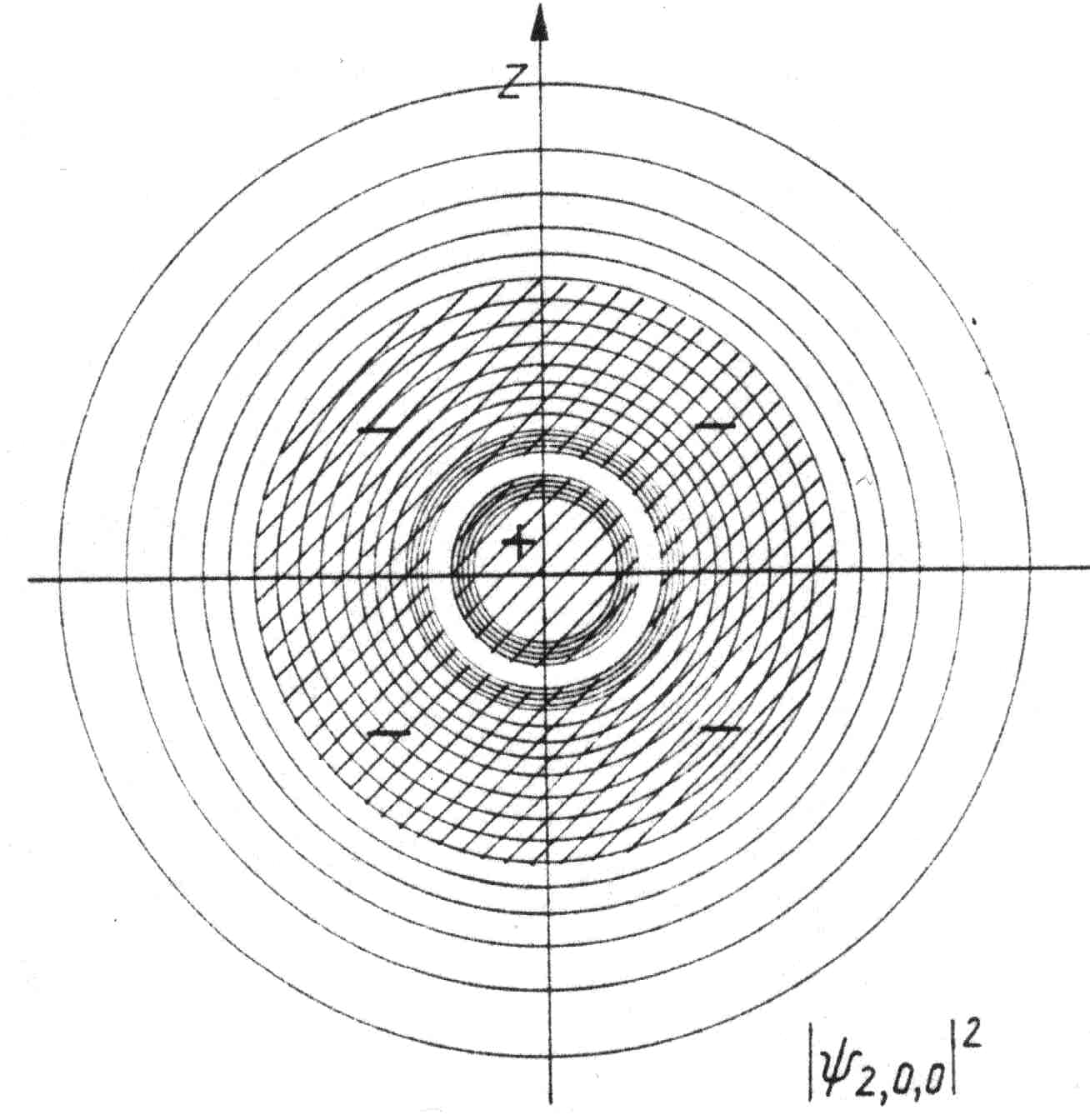
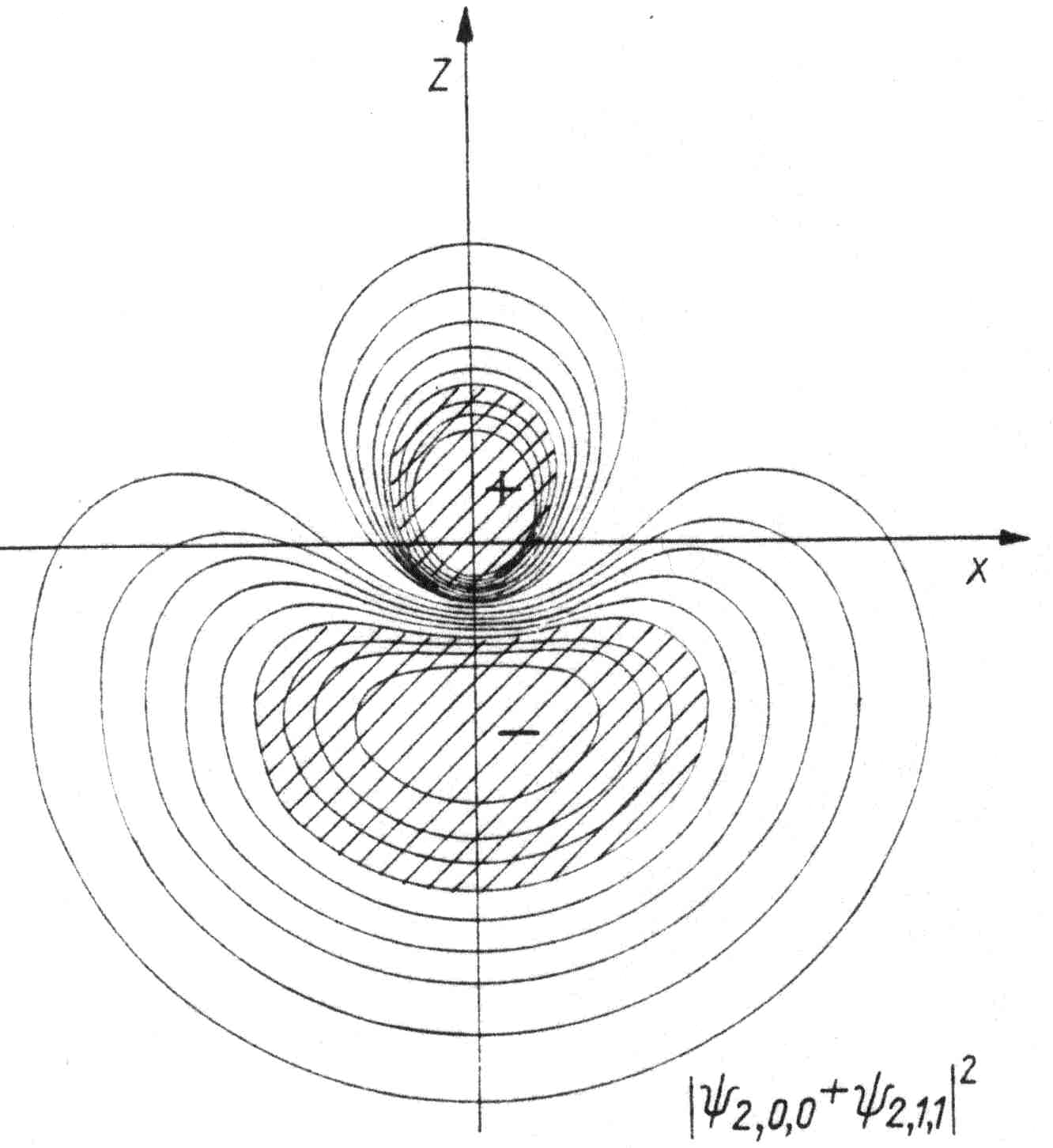
• Taka procedura dodawania funkcji falowych izolowanych atomów, by tworzyły one „płaty” rozciągające się w określonych kierunkach, jest nazywana hybrydyzacją. „Chmura” elektronowa, opisana jako taka kombinacja, nazywana jest hybrydą ![]()
.
16
Wyszukiwarka
Podobne podstrony:
Zadania-lista4, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
numer 20zorione, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
Zadania-lista5, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
Zadania-lista1, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
57c do druku, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
Zadania-lista3, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
Zadania-lista2, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
Zadania-lista6, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
12 fizyka jadrowa, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
1 fale, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
Zadania-lista4, POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Fizyka 2
4. Gospodarka odpadami., POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Ekologia i Zarządzanie Środowis
4. Gospodarka odpadami., POLITECHNIKA WROCŁAWSKA (2009), Semestr II, Ekologia i Zarządzanie Środowis
str tyt pc, Politechnika Wrocławska Energetyka, - MGR II semestr, Pompy ciepła
zadania 1-odpowiedzi, Politechnika Wrocławska PWr, semestr 1, fizyka 1, zadania
str tyt kolektor, Politechnika Wrocławska Energetyka, - MGR II semestr, Systemy energetyczne z wykor
propozycje, Politechnika Wrocławska Energetyka, I semestr, Fizyka 1.2, Wyklady fizyka, Wyklady fizyk
Program wykładów z fizyki, Politechnika Wrocławska Energetyka, I semestr, Fizyka 1.2
zadania 1, Politechnika Wrocławska PWr, semestr 1, fizyka 1, zadania
więcej podobnych podstron