1/ 3 |
2/ 3 |
3/ 4 |
4/ 3 |
5/ 3 |
6/ 2 |
7/ 4 |
8/ 3 |
9/ 5 |
10/4 |
11/5 |
12/ 4 |
13/ 4 |
14/ 4 |
15/ 2 |
Σ 53 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Egzamin z chemii po I roku studiów na Wydziale Lekarskim
Akademii Medycznej
......................................................................... Bydgoszcz, 11 czerwca 2004
imię i nazwisko
ZESTAW A
Roztwór zawiera 5% NaCl, 5% KCl i 5% KBr. Jakich jonów jest w tym roztworze
najwięcej przy założeniu, ze stopnie dysocjacji wymienionych soli są w tym roztworze równe 100% ? Odpowiedź uzasadnij stosownymi obliczeniami. ( 3 pkt )
(Na-23, Cl-35.5, K-39, Br-80)
Przygotowano po 10 cm3 0,1 molowych wodnych roztworów dziesięciu substancji,
zmieszano je w probówkach parami:
H2SO4 i NaOH
HNO3 i Ba(OH)2
HCl i NH3
CH3COOH i KOH
HCl i AgNO3
i do każdej z tych probówek dodano roztworu fenoloftaleiny. W której ( których ) probówkach fenoloftaleina pozostanie bezbarwna? Odpowiedź uzasadnij. ( 3 pkt )
Ile 0,05 mol/l roztworu NaOH trzeba dodać do 20 cm3 0,1 mol/l roztworu HCl aby pH otrzymanego roztworu było 2. (4 pkt)
W jakim stosunku molowym zmieszano substancję A2 z substancją B2 jeżeli do momentu ustalenia się stanu równowagi reakcji :
A2 + B2 2 AB
przereagowało 80 % związku A2 z utworzeniem produktu AB ( stała równowagi reakcji K = 16 ) ( 3 pkt )
Dla podanych układów redoks potencjały standardowe wynoszą:
MnO2 + 4H+ + 2e 2H2O + Mn2+ Eo = + 1,28 V
Cr2O72- + 14 H+ + 6e 7 H2O + 2 Cr3+ Eo = + 1,36 V
Cl2 + 2e 2Cl- Eo = + 1,36 V
MnO4- + 8H+ + 5e 4H2O + Mn2+ Eo = + 1,52 V
Na tej podstawie odpowiedz na następujące pytania :
czy w środowisku kwaśnym MnO4- może być utleniaczem jonów Cl- do Cl2 ?
czy w środowisku kwaśnym jony Cr2O72- mogą utlenić jony Cl- do Cl2 ?
czy w środowisku kwaśnym jony MnO4- mogą utlenić jony Cr3+ do Cr2O72- ?
Odpowiedzi uzasadnij. ( 3 pkt )
Żelazo występuje na Ziemi w postaci mieszaniny izotopów - głównie 54Fe(5,82%), 56Fe(91,18%), 57Fe(2,1%), 58Fe(0,28%). Które z twierdzeń można uznać za prawdziwe:
żelazo zawarte w hemoglobinie zawiera więcej lżejszych izotopów niż żelazo zawarte w glebie,
izotopy mają te same właściwości chemiczne i skład izotopowy w minerałach i organizmach żywych jest taki sam. (2 pkt)
Do 1000 cm3 obojętnego wodnego roztworu zawierającego 1 mol L-alaniny dodano 0,3 mola NaOH. Jakie będzie pH otrzymanego roztworu jeżeli L-alanina ma pK1= 2,34 i pK2= 9,87. (Zmiany objętości roztworu należy pominąć) (4 pkt)
Nazwij poniższe związki, określ rodzaj izomerii w pokazanych parach struktur a; b; c.
(3 pkt)
a)

b)
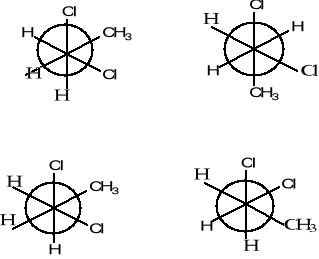
c)

9. Napisz wzory produktów łagodnego utleniania poniższych związków. (5 pkt)
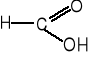
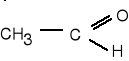
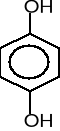
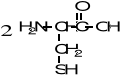
![]()
10.Uzupełnij schemat reakcji , nazwij reagenty.
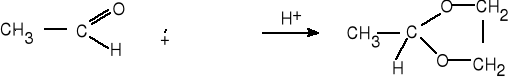
(4 pkt)
11. Podaj nazwę narysowanego niżej związku. Ile asymetrycznych atomów węgla występuje w tej cząsteczce ? Określ konfigurację absolutną C2. Czy związek może ulegać mutarotacji ?
(5 pkt)
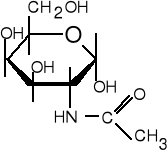
12. Ile protonów wymieni peptyd (angiotensyna) o wzorze:
H-Asp-Arg-Val-Tyr-Val-His-Pro-Phe-His-Leu-OH
gdy roztwór wodny w którym jest rozpuszczony zmieni pH z 1.5 do 11.0 ?
Czy będzie to oddawanie czy przyjmowanie H+ ? (4 pkt)
13. Cząsteczka tłuszczu ma sumaryczny wzór C57H104O6. Ile podwójnych wiązań występuje w tej cząsteczce ? Jakie znane ci kwasy tłuszczowe mogą wchodzić w skład tej cząsteczki ?
(4 pkt)
14. Przedstaw wzorami możliwości tautomerii D-mannozy w roztworach wodnych. (4 pkt)
15. Napisz schemat reakcji mocznika z bezwodnikiem octowym. Nazwij produkt reakcji. (2 pkt)
1/ 3 |
2/ 3 |
3/ 4 |
4/ 3 |
5/ 3 |
6/ 2 |
7/ 4 |
8/ 3 |
9/ 5 |
10/4 |
11/5 |
12/ 4 |
13/ 4 |
14/ 4 |
15/ 2 |
Σ 53 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Egzamin z chemii po I roku studiów na Wydziale Lekarskim
Akademii Medycznej
......................................................................... Bydgoszcz, 11 czerwca 2004
imię i nazwisko
ZESTAW B
Roztwór zawiera 5% NaBr, 5% KBr i 5% KI. Jakich jonów jest w tym roztworze
najwięcej przy założeniu, ze stopnie dysocjacji wymienionych soli są w tym roztworze równe 100% ? Odpowiedź uzasadnij stosownymi obliczeniami. ( 3 pkt )
(Na-23, Cl-35.5, K-39, Br-80)
Wskaż parę ( pary ) tlenków dające w wyniku reakcji związek, który w roztworze wodnym barwi fenoloftaleinę na różowo:
CaO i SO3
Na2O i NO
Al2O3 i SO3
K2O i CO2
Odpowiedź uzasadnij. ( 3 pkt )
Ile 0,1 mol/l roztworu HNO3 trzeba dodać do 20 cm3 0,01 mol/l roztworu KOH aby uzyskać stężenie H+ równe 4,5• 10-2 mol/l ? (4 pkt)
Kwas octowy zmieszano z alkoholem etylowym w ilościach stechiometrycznych i
prowadzono reakcję, w której wydajność po ustaleniu się stanu równowagi wynosiła
60%. Oblicz stałą równowagi tej reakcji. ( 3 pkt )
Dla podanych układów redoks potencjały standardowe wynoszą:
S + 2e S2- Eo = - 0, 51 V
Cr2O72- + 14 H+ + 6e 7 H2O + 2 Cr3+ Eo = + 1,36 V
H2O2 + 2H+ + 2e 2H2O Eo = + 1,78 V
MnO4- + 8H+ + 5e 4H2O + Mn2+ Eo = + 1,52 V
Na tej podstawie odpowiedz na następujące pytania :
czy w środowisku kwaśnym MnO4- może być utleniaczem jonów S2- do So ?
czy w środowisku kwaśnym jony Cr2O72- mogą utlenić jony Mn2+ do MnO4- ?
czy w środowisku kwaśnym jony Cr3+ mogą zredukować H2O2 ?
Odpowiedzi uzasadnij. ( 3 pkt )
Żelazo występuje na Ziemi w postaci mieszaniny izotopów - głównie 54Fe(5,82%), 56Fe(91,18%), 57Fe(2,1%), 58Fe(0,28%). Które z twierdzeń można uznać za prawdziwe:
mężczyźni mają w swojej hemoglobinie więcej lżejszych izotopów żelaza niż kobiety,
izotopy mają te same właściwości chemiczne i skład izotopowy w różnych organizmach żywych jest taki sam. (2 pkt)
Do 1000 cm3 obojętnego wodnego roztworu zawierającego 1 mol L-alaniny dodano 0,3 mola HCl. Jakie będzie pH otrzymanego roztworu jeżeli L-alanina ma pK1= 2,34 i pK2= 9,87. (Zmiany objętości roztworu należy pominąć) (4 pkt)
Nazwij poniższe związki, określ rodzaj izomerii w pokazanych parach struktur a; b; c.
(3 pkt)
a)

b)
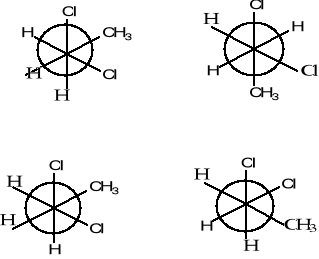
c)

9. Napisz wzory produktów łagodnego utleniania poniższych związków. (5 pkt)
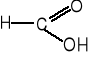
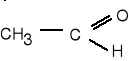
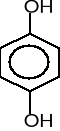
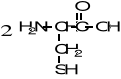
![]()
10.Uzupełnij schemat reakcji , nazwij reagenty.
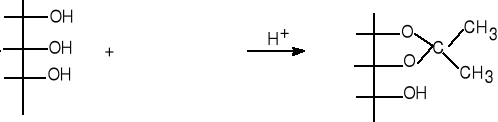
(4 pkt)
11. Podaj nazwę narysowanego niżej związku. Ile asymetrycznych atomów węgla występuje w tej cząsteczce ? Określ konfigurację absolutną C2. Czy związek może ulegać mutarotacji ?
(5 pkt)
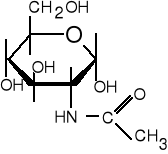
12. Ile protonów wymieni peptyd (angiotensyna) o wzorze
H-Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-His-Leu-OH
gdy roztwór wodny w którym jest rozpuszczony zmieni pH z 11.0 do 1.5 ?
Czy będzie to oddawanie czy przyjmowanie H+ ? (4 pkt)
13. Cząsteczka tłuszczu ma sumaryczny wzór C53H100O6. Ile podwójnych wiązań występuje w tej cząsteczce ? Jakie znane ci kwasy tłuszczowe mogą wchodzić w skład tej cząsteczki ?
(4 pkt)
14. Przedstaw wzorami możliwości tautomerii D-galaktozy w roztworach wodnych. (4 pkt)
15. Napisz schemat reakcji 1-propenu z chlorowodorem w warunkach reakcji jonowej. (2 pkt)
Wyszukiwarka
Podobne podstrony:
Lekarski 2003pop, studia, CHEMIA
Lekarski 2003, studia, CHEMIA
Lekarski 2004pop1, studia, CHEMIA
Lekarski 2004popr2, studia, CHEMIA
Zadania egzaminacyjne 2004, Nieorganiczna, chemia2, Arkusze powtórzeniowe, Pobieranie1, studia 1.2,
Lekarski2002, studia, CHEMIA
Chemia org - Egzamin 09.2004, Studia WNOŻ SGGW 2008-2013, Inżynierskie, Semestr 2, Chemia organiczna
Zestaw nr 6, Studia, chemia
Zestaw 7, Studia, chemia
tos2-2013d, Studia, chemia egzaminy
wapno, Budownictwo-studia, chemia
2 kationy, Studia, Chemia, chemia7
Reakcje jądrowe-podstawowe pojęcia, Studia, chemia jądrowa
chf wykład 6, Studia, Chemia, fizyczna, wykłady
ćw7 - Refrakcja i wyznaczanie momentu dipolowego, studia, chemia fizyczna
I Pracownia - zakres materiału, Studia - Chemia kosmetyczna UŁ, II rok, IV semestr, CHEMIA ORGANICZN
KOLOS kwasy tłuszcze 5, STUDIA, Chemia
nieorgany-pytania2, Studia - Chemia kosmetyczna UŁ, II rok, III semestr, CHEMIA NIEORGANICZNA labora
więcej podobnych podstron