Kinga Sowa Toruń, dn. 7,14.01.2005
Piątek, 1015
ĆWICZENIE NR 4 i 5
Wykonanie ogniwa pierwotnego typoszeregu R.
Kontrolowane wyładowanie ogniwa pierwotnego.
WSTĘP TEORETYCZNY
Ogniwa galwaniczne przetwarzają energię chemiczną w energię elektryczną, służą do dostarczania w sposób okresowy niewielkich ilości energii elektrycznej np. do celów elektroterapii, do dzwonków elektrycznych, układów sygnalizacyjnych, układów telefonicznych, przenośnych odbiornikach, nadajnikach radiowych i itp.. Wytwarzanie ogniw galwanicznych na większą skalę jest nieekonomiczne ze względu na znaczny koszt produkcji tych ogniw. Ogniwa galwaniczne dzieli się na pierwotne i wtórne. Ogniwa pierwotne - nieodwracalne charakteryzują się tym, że przebiegająca w ogniwie reakcja nie da się w całości lub nawet w części odwrócić. Typowym przykładem tego rodzaju układu nieodwracalnego jest ogniwo Leclanchego.
Pierwszy opis braunsztynowego ogniwa podał George Leclanche w 1868 roku. Ogniwo to składa się z pręta ze spieczonego węgla elektrodowego z zaciskiem metalowym, otoczonego sprasowaną mieszanką złożoną z trzech do czterech części braunsztynu naturalnego i sztucznego (otrzymanego przez anodowe utlenianie manganu) oraz jednej części grafitu, który powoduję zwiększenie przewodnictwa masy. Nasycone jest ono roztworem salmiaku (roztwór 20% NH4Cl) z niewielkim dodatkiem sublimatu (HgCl2), a ten po napełnieniu ogniwa wodą w wyniku reakcji wymiany powoduje powleczenie się cynkowej elektrody rtęcią. Mocno sprasowany i wysuszony walec, owinięty gazą bawełnianą lub tkaniną z włókna syntetycznego i nicią stanowi elektrodę dodatnią ogniwa. Mieści się on w naczyniu wykonanym z blachy cynkowej, które służy równocześnie jako biegun ujemny ogniwa, i oddzielony jest od ścian naczynia przepuszczalną dla roztworu elektrolitu wykładziną np. z tektury. Odmianą opisanego ogniwa jest tzw. ogniwo suche, zestawione najczęściej w baterie. Zawiera ono roztwór elektrolitu zabezpieczony przed rozlaniem dodatkiem substancji żelujących. Ze względu na stawiane tym ogniwom dość wysokie wymagania pod względem sprawności część grafitu zastępuje się w nich sadzą acetylenową, której obecność wpływa na polepszenie struktury (porowatość) masy i pozwala na zwiększenie procentowego udziału depolaryzatora w ogniwie.
Ogniwo Leclanchego stanowi układ ![]()
. W ogniwie tym, złożonym z cynkowej anody i węglowej katody, otoczonej tzw. depolaryzatorem zachodzi sumaryczna reakcja przedstawiona za pomocą poniższego równania:
![]()
Stosowanym depolaryzatorem jest braunsztyn, który hamuje wywiązywanie wolnego wodoru. Reakcję przebiegającą na katodzie można sformułować w następujący sposób:
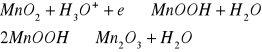
a reakcję na anodzie:
![]()
Mała wartość przewodnictwa elektronowego braunsztynu wymaga dodania do masy depolaryzatora grafitu lub sadzy. Potencjał elektrody ze wzrostem pH staje się bardziej ujemny, a podczas długotrwałej eksploatacji ogniwa szybko maleje. Gdy przerwie się pracę ogniwa, jony OH- mają czas na oddyfundowanie od elektrody i ogniwo „poprawia się”. Pierwotne procesy elektrodowe prowadzą w związku z powstawaniem jonów OH- d dalszych reakcji:
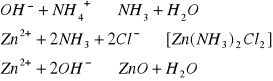
Niewielka cześć amoniaku ulatnia się, reszta tworzy z cynkiem trudno rozpuszczalną sól kompleksową, która wytrąca się w postaci kryształów. Tego rodzaju reakcje następcze powodują, że ogniwo Leclanchego jest nieodwracalne. SEM ogniwa wynosi ok. 1,5V, w przypadku jednak pobierania z ogniwa dużych prądów napięcie na jego zaciskach spada gwałtownie do 1,1 - 1,2V. Ogniwo to nadaje się do pracy w układach otwartych.
Podstawowym równaniem termodynamicznym ogniwa galwanicznego jest równanie:
![]()
gdzie:
E - SEM (siła elektromotoryczna ogniwa);
F- stała Faradaya;
νe - stechiometryczny współczynnik elektronów;
Aby powyższe równanie było jednoznaczne, definicja SEM ogniwa powinna nie tylko jednoznacznie określać wartość, lecz również i znak E. W związku z czym Międzynarodowa Unia Chemii Czystej i Stosowanej stworzyła tzw. konwencję sztokholmską. Określa ona związek pomiędzy zapisem równania stechiometrycznego reakcji, schematem ogniwa odpowiadającego tej reakcji oraz siłą elektromotoryczną tego ogniwa w następujący sposób:
Mając dane równanie stechiometryczne reakcji zapisujemy odpowiadający mu schemat ogniwa, tak by wynikająca z równania reakcja redukcji zachodziła w półogniwie prawym, reakcja utleniania zaś - w półogniwie lewym;
Siłą elektromotoryczną ogniwa nazywamy potencjał elektrostatyczny drutu przyłączonego do elektrody znajdującej się na schemacie ogniwa po prawej stronie, mierzony w stanie równowagi względem potencjału drutu z tego samego metalu przyłączonego do elektrody lewej:
![]()
W czasie pracy ogniwa elektrochemicznego następuje przeniesienie ładunków poprzez granicę faz, a mianowicie z wnętrza jednej fazy metalicznej (elektrody) do wnętrza drugiej oraz z fazy metalicznej do roztworu i na odwrót. Efekty energetyczne takich procesów określane są przez różnice potencjałów Galvaniego obu faz. Potencjałem Galvaniego (φ) danej fazy nazywa się pracę elektrostatyczną potrzebną do przeniesienia jednostkowego ładunku dodatniego z punktu bardzo oddalonego, leżącego poza fazą (w próżni) do jej wnętrza. Potencjał ten różni się od potencjału Volty (ψ) o wartość pracy elektrostatycznej, związanej z przekazaniem ładunku przez granicę faz, czyli o tzw. potencjał powierzchniowy (χ):
![]()
Przyczyny, dla których na granicy faz metal/elektrolit występuje różnica potencjałów elektrostatycznych są następujące:
wybiórcza adsorpcja jonów jednego rodzaju, powodująca nagromadzenie się ładunku jednego znaku w sąsiedztwie granicy faz, i dla zachowania elektroobojętności układu w całości, wytworzenie rozmytego ładunku przeciwnego znaku we wnętrzu tej samej fazy. W tym przypadku różnica potencjałów umiejscowiona jest w obrębie jednej fazy.
adsorpcja polarnych cząsteczek rozpuszczalnika bądź substancji rozpuszczonej, zachodzącą w taki sposób, że dipole orientują się na granicy faz. Spadek potencjału zlokalizowany jest wówczas również w obrębie jednej fazy, na grubości jednej lub kilku warstw cząsteczkowych.
LITERATURA
K. Pigoń, Z. Ruziewicz, „Chemia fizyczna”
J. Koryta, :Elektrochemia”
G. Kortum, „Elektrochemia”
S. Pawlikowski, „Zarys elektrochemii technicznej”
C. L. Mantell, „Elektrochemia przemysłowa”
CZĘŚĆ DOŚWIADCZALNA
Po przygotowaniu mieszanek depolaryzacyjnych wykonano dwa ogniwa R-14. Następnie zmierzono napięcie początkowe wykonanych baterii. Wyniki zestawiono w poniższej tabeli:
Bateria |
U0 [V] |
chińska |
1,8494 |
belgijska |
1,6601 |
Po tygodniu, oba ogniwa (bateryjki) z różnymi depolaryzatorami poddano kontrolnemu wyładowaniu. Na początku zmierzono napięcie początkowe dla czasu t = 0. Po zmierzeniu napięcia początkowego przyłożono stały opór w wartości 2Ω i wykonywano pomiar napięcia w odpowiednich odstępach czasu. Uzyskane wyniki zestawiono w poniższej tabeli:
t [min] |
Bateria chińska |
Bateria belgijska |
|
U0 [V] |
|
0 |
1,6573 |
1,5505 |
|
U [V] |
|
1 |
1,0026 |
0,2352 |
2 |
0,9459 |
0,2703 |
3 |
0,9782 |
0,3012 |
4 |
1,0023 |
0,3181 |
5 |
1,0185 |
0,3362 |
6 |
1,0241 |
0,3551 |
7 |
1,0200 |
0,3733 |
8 |
1,0770 |
0,3920 |
9 |
0,9988 |
0,4064 |
10 |
0,9855 |
0,4212 |
11 |
0,9733 |
0,4342 |
12 |
0,9606 |
0,4479 |
13 |
0,9468 |
0,4628 |
14 |
0,9350 |
0,4738 |
15 |
0,9229 |
0,4871 |
17 |
0,8991 |
0,5137 |
19 |
0,8770 |
0,5395 |
21 |
0,8573 |
0,5581 |
23 |
0,8387 |
0,5704 |
25 |
0,8250 |
0,5752 |
27 |
0,8126 |
0,5757 |
29 |
0,7972 |
0,5734 |
31 |
0,7841 |
0,5682 |
33 |
0,7716 |
0,5616 |
35 |
0,7568 |
0,5542 |
37 |
0,7455 |
0,5490 |
39 |
0,7389 |
0,5456 |
41 |
0,7259 |
0,5383 |
43 |
0,7134 |
0,5312 |
45 |
0,7067 |
0,5270 |
50 |
0,6787 |
0,5111 |
55 |
0,6531 |
0,4946 |
60 |
0,6321 |
0,4781 |
65 |
0,6116 |
0,4638 |
70 |
0,5949 |
0,4487 |
75 |
0,5785 |
0,4347 |
80 |
0,5622 |
0,4225 |
85 |
0,5478 |
0,4114 |
90 |
0,5322 |
0,4004 |
95 |
0,5171 |
0,3893 |
100 |
0,5033 |
0,3788 |
105 |
0,4906 |
0,3685 |
Na odstawie uzyskanych wyników pomiarów sporządzono wykresy U = f(t) dla różnych depolaryzatorów, które znajdują się w dołączonych załącznikach.
Po dokładnym przeanalizowaniu wykresów opisujących zmianę napięcia w funkcji czasu stwierdzono, że:
Zarówno w przypadku baterii chińskiej, jak i belgijskiej na początku procesu wyładowywania widoczny jest wzrost wartości napięcia wraz ze wzrostem czasu. Spowodowane jest to zapewne niedokładnością w wymieszaniu (połączeniu) ze sobą wszystkich składników ogniwa R-14, prawdopodobnie nastąpiło jakieś przeniesienie masy w układzie;
Odpowiednio dla baterii chińskiej i belgijskiej maksymalna wartość napięcia, od którego następuje spadek wartości wraz ze wzrostem czasu wynosi 1,0770V i 0,5757V;
Dalszy przebieg krzywych ma charakter prawidłowy - spadek napięcia wraz ze wzrostem czasu, podczas którego przyłożony jest stały opór - wyładowanie następuje w sposób prawidłowy potwierdzający założenia teoretyczne;
Wykorzystując jako depolaryzator braunsztyn chiński uzyskano większą wartość SEM ogniwa niż w przypadku wykorzystania braunsztynu belgijskiego. Wiadomo, ze skuteczność działania depolaryzatora zależy w sposób istotny od struktury stosowanego braunsztynu i ewentualnych wad strukturalnych sieci krystalicznej, które sztucznie się powiększa (tzw. braunsztyn aktywowany).
Sporządzono wykresy zależności natężenia prądu w funkcji czasu na podstawie wartości natężenia obliczonych na podstawie poniższej zależności:
![]()
R = 2Ω
Wyniki obliczeń zestawiono w poniższej tabeli:
|
Bateria chińska |
Bateria belgijska |
t [min] |
U [V] |
|
1 |
0,5013 |
0,1176 |
2 |
0,4730 |
0,1352 |
3 |
0,4891 |
0,1506 |
4 |
0,5012 |
0,1591 |
5 |
0,5093 |
0,1681 |
6 |
0,5121 |
0,1776 |
7 |
0,5100 |
0,1867 |
8 |
0,5385 |
0,1960 |
9 |
0,4994 |
0,2032 |
10 |
0,4928 |
0,2106 |
11 |
0,4867 |
0,2171 |
12 |
0,4803 |
0,2240 |
13 |
0,4734 |
0,2314 |
14 |
0,4675 |
0,2369 |
15 |
0,4615 |
0,2436 |
17 |
0,4496 |
0,2569 |
19 |
0,4385 |
0,2698 |
21 |
0,4287 |
0,2791 |
23 |
0,4194 |
0,2852 |
25 |
0,4125 |
0,2876 |
27 |
0,4063 |
0,2879 |
29 |
0,3986 |
0,2867 |
31 |
0,3921 |
0,2841 |
33 |
0,3858 |
0,2808 |
35 |
0,3784 |
0,2771 |
37 |
0,3728 |
0,2745 |
39 |
0,3695 |
0,2728 |
41 |
0,3630 |
0,2692 |
43 |
0,3567 |
0,2656 |
45 |
0,3534 |
0,2635 |
50 |
0,3394 |
0,2556 |
55 |
0,3266 |
0,2473 |
60 |
0,3161 |
0,2391 |
65 |
0,3058 |
0,2319 |
70 |
0,2975 |
0,2244 |
75 |
0,2893 |
0,2174 |
80 |
0,2811 |
0,2113 |
85 |
0,2739 |
0,2057 |
90 |
0,2661 |
0,2002 |
95 |
0,2586 |
0,1947 |
100 |
0,2517 |
0,1894 |
105 |
0,2453 |
0,1843 |
WNIOSKI KOŃCOWE
Dwa ogniwa pierwotne (bateryjki R-14) zawierające odpowiednio depolaryzatory: braunsztyn chiński i braunsztyn belgijski zostały poddane analizie wyładowania, przeprowadzonej w sposób ciągły poprzez opornik o stałym oporze (wyładowanie stałoprądowe). Na podstawie uzyskanych wyników, można ogólnie stwierdzić, ze cały układ pracuje w sposób niedoskonały. W związku z czym otrzymane ogniwa nadają się jedynie do pracy okresowej.
Wyszukiwarka
Podobne podstrony:
666 667
SPAWALNICTWO, Studia, SEMESTR 5, IWIŁMI, od pudlo (pradzik 666)
Księga 2. Postępowenie nieprocesowe, ART 666 KPC, III CZP 12/08 - z dnia 2 kwietnia 2008 r
666
666 FFF
666
666 FFF, Szatan, egzorcyzmy, okultyzm, zagrożenia
demoniczna liczba to 616 a nie 666 jak sadzono eioba
666
Złowroga liczba 666, CHRZESCIJANSTWO, WIZJE PRZEPOWIEDNIE, CZASY OSTATECZNE
666
666
50 Science 306 666 669 2004 id Nieznany (2)
Pytania na spawalnictwo, Studia, SEMESTR 5, IWIŁMI, od pudlo (pradzik 666)
666, Dokumenty AWF Wychowanie Fizyczne, Konspekty Wychowanie Fizyczne
666 FFF(1), satanizm opetanie egzorcyzmy
666 id 44435 Nieznany
więcej podobnych podstron