ENZYMOLOGIA
wykład 8
22.04.2009
PEKTYNAZY - hydrolazy
hydrolizują wiązania glikozydowi w pektynach,
ułatwiają uwalnianie soków z miazgi, klarowanie soków (usuwanie zmętnień pektynowych),
pektyny są heteropolisacharydami, składają się głównie z połączonych ze sobą wiązaniami α-1,4- glikozydowymi jednostek kwasu D-galakturonowego, w znacznej części zestryfikowanych gr. metylowymi,
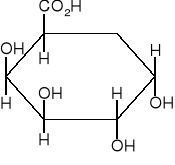
kwas galakturonowy - powstaje na skutek utleniania α-D-galaktozy, posiada grupę aldehydową przy C1 i karboksylową przy C6.
β-D-galaktozydaza - hydrolaza (usuwanie laktozy z mleka)
Reduktaza diacetylowa (RA) - oksydoreduktaza
Diacetyl + NADH + H+ ↔ NAD + Acetoina
Diacetyl (produkcja piwa)
diketon o nazwie systematycznej 2,3-butandion, zapachu maślanym,
znajduje się w piwie jako produkt uboczny fermentacji przez drożdże, przy odpowiednim stężeniu wykazuje korzystne właściwości - pozwala dłużej odczuwać w ustach smak piwa,
w stężeniu większym niż 0,2 mg/l nadaje piwu niekorzystny „maślany posmak”,
powstaje w wyniku przetwarzania cukrów przez drożdże, czasami bakterie w procesie fermentacji,
w czasie leżakowania piwa te same drożdże redukują diacetyl do obojętnych smakowo produktów (acetoina, butandiol).
Zastosowanie immobilizowanych komórek mikroorganizmów głównie drożdży:
(nauczyć się 4):
do zwiększenia wydajności fermentacji alkoholowej trudnych do zhydrolizowania substratów np.: immobilizacja Schizosaccharomyces pombe wraz z izomerazą ksylozy, umożliwiło otrzymanie etanolu z ksylozy,
immobilizowane w żelu alginianowym komórki Kluyveromyces fragilis zastosowano do hydrolizy laktozy w mleku i przygotowania mleka przeznaczonego dla osób nietolerujących cukier mlekowy,
do biodegradacji cholesterolu w mleku zastosowano komórki Rhodococcus egni,
immobilizowane komórki Streptococcus albus i olivaceus - w biosyntezie izomerazy glukozowej,
immobilizowane Erwinia rhapontici lub Protaminobater rubrum zawierający syntezę izomaltulozy, do produkcji izomaltulozy - cukru znajdującego się w miodzie,
bakterie z rodzaju Acetobacter zaadsorbowane na powierzchni porowatego nośnika, którym najczęściej są wióry bukowe do produkcji kwasu octowego poprzez utlenianie alkoholu etylowego - pierwsza technologia, w której zastosowano biokatalizator unieruchomiony.
Stosowanie całych komórek eliminuje procesy wyodrębniania i oczyszczania enzymów → obniżenie kosztów produkcji.
Stabilność enzymów w komórce jest wyższa niż enzymów wyizolowanych.
PEPTYDAZY (enzymy proteolityczne, proteazy)
katalizują hydrolizę wiązań peptydowych w białkach i peptydach (podstawowe zadanie),
należą do klasy 3 - hydrolaz,
niektóre z nich katalizują ponadto hydrolizę wiązań estrowych i amidowych oraz reakcję transpeptydacji i transamidacji,
w odpowiednich warunkach niektóre peptydazy mogą ponadto syntetyzować wiązanie peptydowe.
Ugrupowanie peptydowe
Hydroliza i resynteza wiązania peptydowego
W roztworach wodnych stan równowagi tej reakcji przesunięty jest w stronę hydrolizy. Zmniejszając stężenie wody, np. poprzez dodanie rozpuszczalnika organicznego, równowaga zostaje przesunięta w stronę syntezy wiązań peptydowych na drodze kondensacji hydrolitycznej.
W środowisku wodnym mogą zachodzić reakcje resyntezy wiązań, ale muszą być spełnione odpowiednie warunki (pH, stężenie substratu).
Peptydazy - niska specyficzność substratowa, jednakże charakteryzują się wybiórczością w stosunku do położenia rozkładanego wiązania w łańcuchu polipeptydowym oraz swoistością w stosunku do hydrolizy wiązań pomiędzy określonymi aminokwasami.
Klasyfikacja:
Egzopeptydazy - EC 3.4.11-19 (odcinają 1 lub 2 aminokwasy od końca N lub C)
aminopeptydazy EC 3.4.11:
odcinające pojedyncze aminokwasy od końca aminowego,
karboksypeptydazy EC 3.4.16-18:
odcinające pojedyncze aa od końca karboksylowego,
dipeptydazy EC 3.4.14:
hydrolizują wiązania peptydowe w dwupetydach,
dwupeptydylo-peptydazy lub tripeptydylo-peptydazy
odszczepiają jednostki dwupetydowe lub tripeptydowe od końca N (EC 3.4.14) lub końca C (EC 3.4.15),
omega peptydazy EC 3.4.19:
odcinające różnie podstawione reszty aminokwasowe.
Endopeptydazy (proteinazy) - EC 3.4.21-24, EC 3.4.99 (hydrolizują wiązania wewnątrz łańcucha polipeptydowego)
Na podstawie budowy centrum, wrażliwości na inhibitory oraz mechanizm katalizy wyróżniono:
serynowe EC 3.4.21
seryna oraz histydyna w centrum aktywnym, są hamowane przez DFP
cysteinowe EC 3.4.22
cysteina i histydyna w centrum aktywnym, wrażliwość na czynniki utleniające, hamowane przez PCMB
aspartylowe EC 3.4.23
dwie reszty asparaginianu w centrum aktywnym, aktywność przy niskim pH 1.5-5
metaloproteinazy EC 3.4.24
inhibicja przez EDTA
Endopeptydazy o znaczeniu przemysłowym
Enzym |
EC numer |
Preferencyjna hydrolizax |
Serynowe proteazy chymotrypsyna trypsyna subtylizyna |
3.4.21 3.4.21.1 3.4.21.4 3.4.21.12 |
Tyr-, Trp-, Phe-, Leu- Arg-, Lys-, Głównie hydrofobowe |
Cysteinowe proteazy Katepsyna B* Papaina* Ficyna* Bromalina* |
3.4.22 3.4.22.1 3.4.22.2 3.4.22.3 3.4.22.32-33 |
Arg-Arg-, Lys-, Phe-X- Arg-, Lys-, hydrofobowe-X- Phe-, Tyr- Lys-, Arg-, Phe-, Tyr- |
Aspartylowe proteazy Pepsyna Chymozyna# |
3.4.23 3.4.23.1 3.4.23.4 |
Phe-, Tyr-, Leu-, Asp-, Glu- Phe105-Met106 w κ-kazeinie |
Metaloproteazy Termolizyna Neutralne proteinazy |
3.4.24 3.4.24.27 3.4.24.28 |
Ile-, Leu-, Val-, Phe-, Leu-, Phe-, i inne |
* szeroka specyficzność w stosunku do aminokwasów hydrolizowanego wiązania peptydowego
# specyficzność podobna do pepsyny
x preferencyjna hydroliza:
Aminokwas - wiązanie od grupy karbonylowej (aminokwas dostarczający grupę karbonylową
Aminokwas - Aminokwas wiązanie między dwoma konkretnymi aminokwasami
Egzopeptydazy ważne dla przemysłu spożywczego:
Aminopeptydazy i karboksypeptydazy
Lactococcus lactis
Aspergillus sp.
Rhizopus oryzae
Zastosowanie: usuwanie gorzkiego smaku z hydrolizatów białkowych, także przy produkcji sera.
Otrzymywanie i zastosowanie peptydaz roślinnych
Papaina, bromelina, ficyna - wewnątrzkomórkowe proteazy cysteinowe, optimum pH 5-7
Enzym |
Źródło |
Skala produkcji |
Główne zastosowanie |
Papaina |
Sok z niedojrzałych owoców papai (Carica papaya) |
> 10 t/rok |
Kruszenie mięsa, browarnictwo - usuwanie zmętnienia piwa |
Bromelina |
Sok (lateks) z pnia ananasa |
< 1 t/rok |
Browarnictwo, kruszenie mięsa |
Ficyna |
Sok z niektórych odmian drzew figowych gł. Ficus glabrata |
< 1 t/rok |
Modyfikacja składników żywności |
Ficyna - najdroższa, stąd najrzadziej stosowana
Komercyjne otrzymywanie papiny
Zebranie mleczka kauczukowego z niedojrzałych owoców papai
(nacięcie rano, z 1 drzewa 1 l rocznie, mleczko przypomina wyglądem mleko krowie, po kilku minutach po wypływie z naciętego owocu ścina się i tworzy żel)
Schłodzenie
Mieszanie mechaniczne → żel w płyn
Wstępna filtracja i odwirowanie
Ultrafiltracja
Klarowny i przezroczysty przesącz zagęszcza się w próżni oraz suszy w suszarni rozpyłowej
Mielenie na proszek i pakowanie
Preparat enzymatyczny papainy otrzymywany jest na miejscu (w tropikach) ze względu na wysoką niestabilność - ale jego produkcja jest nieskomplikowana, niedroga - później transport do innych krajów).
Suszenie rozpyłowe polega na rozprowadzeniu cieczy w postaci mgiełki drobnych kropli i poddaniu odparowaniu stosując bardzo wysoką temperaturę (200-250°C). Preparaty w postaci stałej są bardziej stabilne niż preparaty ciekłe.
Otrzymywanie i zastosowanie peptydaz zwierzęcych
Zewnątrzkomórkowe enzymy trawienne:
Enzym |
Źródło |
Skala produkcji |
Główne zastosowanie |
Chymozyna |
Żołądek młodych cielaków |
> 1 t/rok |
Serowarstwo |
Pepsyna |
Żołądek świni |
< 1 t/rok |
Modyfikacja składników żywności, serowarstwo |
Trypsyna |
Trzustka świni lub bydła |
< 1 t/rok |
Modyfikacja składników żywności, hydrolizaty białkowe, odwłasianie skór |
Chymotrypsyna |
Trzustka świni |
< 1 t/rok |
Modyfikacja składników żywności, odwłasianie skór |
Komercyjne otrzymywanie pepsyny przemysłowej
Rozdrobnienie i mielenie surowca (wyściółko żołądka świni)
Autoliza śluzówki żołądka w obecności HCl
Usunięcie tłuszczu heksanem
Wysolenie solą lub izopropanolem
Rozpuszczenie w wodzie
Filtrowanie, suszenie sublimacyjne (45-55oC) w próżni
(odparowanie heksanu i izopropanolu)
Mielenie na proszek i pakowanie
Otrzymywanie peptydaz z mikroorganizmów
Enzym |
Źródło |
Skala produkcji |
Główne zastosowanie |
Neutralne peptydazy |
Bacillus subtilis |
> 100 t/rok |
Hydrolizaty białkowe, dodatek do proszków do prania, browarnictwo |
Kwaśne peptydazy gł. koagulaty białek mleka |
Rhizmucor miehei |
> 10 t/rok |
Serowarstwo |
Kwaśne peptydazy |
Aspergillus niger, Aspergillus oryzae |
> 1 t/rok |
Piekarnictwo, wytrawianie skór |
Neutralne proteinazy Bacillus subtilis; proteinazy serynowe, metaloproteinazy.
Podpuszczka - handlowa nazwa zalecana dla preparatów z żołądków przeżuwaczy zawierająca głównie chymozyną i w niewielkim stopniu pepsynę (Międzynarodowa Federacja Mleczarska).
Peptydazy pochodzenia mikrobiologicznego zdolne do koagulacji białek mleka zaleca się nazywać koagulantami białek mleka.
Produkcja hydrolizatów białkowych odbywa się w wyniku enzymatycznej lub kwasowej/zasadowej hydrolizy białek)
Enzymatyczne modyfikacja składu i właściwości białek - hydrolizaty białkowe
Enzymatyczna hydroliza białek nie powoduje rozkładu aminokwasów, jest bardziej specyficzna od hydrolizy kwasowej i alkalicznej białek.
W wyniku częściowej proteolizy
Zmieniają się reologiczne, fizyczne, chemiczne właściwości białek,
Powstają charakterystyczne cechy smakowe i zapachowe produktów.
Np. hydrofobowe aa schowane wewnątrz cząsteczki białka zostają odsłonięte, najczęściej powstaje gorzki smak, zwiększa się rozpuszczalność, obniża napięcie powierzchniowe, zwiększa się zdolność do emulgowania tłuszczów (tworzenia emulsji) i tworzenia piany, wzrasta strawność i przyswajalność produktu.
Gdy jednak zbyt długo prowadzi się hydrolizę to właściwości emulgujące i tworzenia piany mogą spadać.
Hydrolizaty białek na skalę przemysłową otrzymuje się z:
białek mleka (kazeiny, albuminy, białka serwatkowe),
białek mięsa, soi, glutenu pszenicy, fibrynogenu lub kolagenu.
Hydrolizaty białkowe - zastosowanie
Jako koncentraty spożywcze i przyprawowe, np. zupy instant, sosy sojowe, przyprawy do pieczenia mięsa, buliony mięsne w proszku,
Dodatki do żywności wytwarzające i stabilizujące pianę, emulgujące tłuszcze, modyfikujące smak, poprawiające teksturę i ułatwiające krojenie, np. do parówek,
Do otrzymywania żywności przeznaczenia specjalnego:
odżywki dla niemowląt,
preparaty odchudzające,
odżywki białkowe dla sportowców,
odżywki o obniżonej alergenności dla dzieci „atopowych” oraz z zaburzeniami wchłaniania i trawienia o podłożu immunologicznym, niealergizującym,
Wzbogacanie produktów w białko, np. chleba i żywności specjalnej.
Laktoalbumina zawarta w białku serwatkowym mleka krowy oraz albumina jaja zostały uznane za białka o najwyższej wartości odżywczej przez FAO/WHO (nie tylko zawartość egzogennych aminokwasów, ale i proporcje aminokwasów egzogennych do endogennych) => ale RYZYKO REAKCJI ALERGICZNYCH!!!
Odżywki dla dzieci otrzymuje się z białek serwatkowych, kazeiny, białka soi.
Reakcje alergiczne wywołują sekwencje aminokwasowe występujące w białku nazwane EPITOPAMI, przeciw którym organizm produkuje przeciwciała.
W jednym białku może znaleźć się kilka epitopów. Poprzez hydrolizę wiązań peptydowych zmniejszamy rozmiary peptydów => zmniejsza się liczba cząsteczek zawierających 2 lub więcej epitopów lub bezpośrednio rozbijane są sekwencje aminokwasowe epitopu => obniżenie lub pozbawienie właściwości alergizujących.
Proces plasteinowania, jako przykład polepszania jakości białek
Enzymatyczna reakcja resyntezy wiązań peptydowych (w konkretnych warunkach),
Enzymatyczne przeprowadzanie hydrolizatów białkowych w peptydy wielkocząsteczkowe, nierozpuszczalne w 10% TCA o konsystencji żelu nazwanego „plasteiną”.
Proces dwuetapowy:
ETAP 1: polega na częściowej hydrolizie wiązań peptydowych białek przy użyciu proteinaz, takich jak pepsyna, papaina, α-chymotrypsyna.
ETAP 2: otrzymany uprzednio hydrolizat białkowy (mieszanina peptydów), po zatężeniu, poddaje się reakcji plasteinowania katalizowanej przez enzymy, takie same bądź inne niż stosowane w procesie hydrolizy, lecz przy pH innym niż w procesie hydrolizy w wyniku, czego otrzymuje się plasteinę charakteryzującą się, w porównaniu z białkiem wyjściowym, lepszym składem jakościowym oraz obniżoną zawartością substancji antyżywieniowych.
Schemat technologiczny otrzymywania plastein
KIERUNKI WYKORZYSTYWANIA REAKCJI PLASTEINOWANIA
wbudowywanie aminokwasów egzogennych w białka, np. gluten (białko zapasowe zbóż) w lizynę, zeinę w lizynę, tryptofan,
usuwanie niepożądanych aminokwasów w przypadku szczególnych diet, np. w fenyloketonurii konieczne jest wyeliminowanie z produktów fenyloalaniny (do produkcji hydrolizatów wykorzystywane są rybny koncentrat białkowy i białko sojowe),
usuwanie gorzkiego smaku hydrolizatów białkowych - usunięcie aminokwasów hydrofobowych lub ich ukrycie wewnątrz długich łańcuchów plastein,
usuwanie właściwości alergennych białek - usunięcie części epitopów (z końca N lub C) , rozbicie epitopów lub ich ukrycie wewnątrz łańcuchów plastein => konieczność poznania sekwencji aminokwasowych uczulających.
ZASTOSOWANIE PEPTYDAZ
PIEKARNICTWO
rozluźnienie zbyt mocnego białka glutenowego mąki, co prowadzi do skrócenia czasu wyrabiania ciasta, polepsza jego pulchność i konsystencję (peptydazy grzybowe i bakteryjne),
BROWARNICTWO
podczas przerobu zbożowych surowców niesłodowanych w celu zapewnienia odpowiednich właściwości organoleptycznych (zapachu, pienistości, klarowności) => stabilizacja piwa (szczególne znaczenie przy schładzaniu piwa),
przy słodowaniu jęczmienia i w początkowej fazie zacierania słodu => odpowiedni stopień rozkładu substancji białkowych,
PRZEMYSŁ MIĘSNY
przyspieszenie procesu dojrzewania mięsa, głównie wołowego, poprzez częściowy rozkład ... białka włókna mięśniowego uzyskuje się poprawę konsystencji (delikatność, kruchość), poprawę wartości odżywczej i cech organoleptycznych => 2-3 x skrócony czas dojrzewania => zwiększona strawność,
oddzielenie resztek mięsa od kości - zwiększenie odzysku białka,
zmiękczanie, odwłasianie skór,
zwiększenie wydajności ekstrakcji tłuszczu,
PRZEMYSŁ RYBNY
dojrzewanie solonych, marynowanych śledzi (pleśnie Aspergillus),
MLECZARSTWO
koagulacja białek mleka w produkcji sera,
produkcja hydrolizatów kazeiny,
produkcja mleka sojowego, mleka w proszku,
w procesie dojrzewania sera - proces złożony, proteoliza niezbędna do uzyskania prawidłowej struktury, głębokiego smaku, dostarczenia aminokwasów niezbędnych do wytworzenia charakterystycznego smaku i zapachu.
Koagulanty wykorzystywane w produkcji i dojrzewaniu serów stosowane są szeroko ze względu na niespecyficzność substratową tych preparatów.
W przypadku podpuszczki niespecyficzna proteoliza nie rozluźnia skrzepu i nie powoduje przechodzenia produktów degradacji kazeiny do serwatki.
Natomiast inne koagulanty białek mleka (trypsyna, chymotrypsyna, papaina) oraz bakteryjne proteinazy hydrolizują niespecyficznie białka mleka - w długim czasie prowadzi to do rozluźnienia skrzepu, strat tłuszczu, strat niskocząsteczkowych związków.
PREPARATY PODPUSZCZKOZASTĘPCZE - cechy:
duża aktywność ścinająca białka mleka (koagulacja)
niska niespecyficzna aktywność proteolityczna
Jedynym producentem enzymatycznych preparatów amylolitycznych, pektynolitycznych i proteolitycznych w Polsce są Zakłady Przemysłu Ococowo-Warzywnego PEKTOWIN w Jaśle.
Roztwór białek
Częściowa hydroliza
do peptydów
Endopeptydaza,
np. pepsyna
Odszczepienie niepożądanych aminokwasów
Egzopeptydaza
Rozdzielenie
Niepożądane aminokwasy
Zagęszczenie
Woda
Reakcja plasteinowa w 50 % roztworze substratów
Estry etylowe pożądanych aminokwasów
Rozpuszczalnik organiczny
Rozdzielenie
Frakcja związków małocząsteczkowych
Hydroliza wiązań estrowych
Alkohol etylowy
NaOH
Plasteiny o pożądanym składzie aminokwasowym
Wyszukiwarka
Podobne podstrony:
wyklady2, Technologia żywności i żywienia człowieka, Enzymologia
wyklady2, Technologia żywności i żywienia człowieka, Enzymologia
wyklady2, Technologia żywności i żywienia człowieka, Enzymologia
pytania na I kolo z enzymologii, Technologia żywności i żywienia człowieka, Enzymologia
Prawo Żywnościowe - Wykłady, Technologia żywności i żywienia człowieka, Prawo żywnościowe
2015 pyt tren do wykładu V, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, c
Suszarnictwo - Wykłady, Technologia żywności i żywienia człowieka, Przechowalnictwo, suszarnictwo
zywienie czlowieka wyklady, Technologia żywnosci i Żywienie człowieka, 2 semestr, podstawy żywienia
Biochemia - Wykłady, Technologia żywności i żywienia człowieka, Biochemia
2015 pyt tren do wykł VII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, ch
Fluidyzacja, Technologia Żywności i Żywienie Człowieka, IV semestr, Obróbka cieplna produktów spożyw
Wykad 6, Technologia żywnosci i Żywienie człowieka, 3 semestr, BIOCHEMIA, wykłady, wykład 6 materiał
pytania treningowe wykład II 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizy
2015 pytania tren do wykł VI, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna,
pyt tren wykł III 2015, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
zywienie w05, Technologia żywnosci i Żywienie człowieka, 2 semestr, podstawy żywienia człowieka, wyk
Ochrona-Wlasnosci-Intelektualnych-wyklady, Politechnika Łódzka, Technologia Żywności i Żywienie Czlo
2015 pyt tren wykł VIII, Technologia żywnosci i Żywienie człowieka, 2 semestr, chemia fizyczna, chem
więcej podobnych podstron