Chemiczna analiza instrumentalna
Wydział Geodezji Górniczej i Inżynierii Środowiska
Kierunek: Inżynieria Środowiska
Ćwiczenie 2: Pomiary SEM ogniwa - miareczkowanie potencjometryczne. Pomiary przewodnictwa roztworów - miareczkowanie konduktometryczne
(Sprawozdanie drukować dwustronnie i wypełniać odręcznie)
Imię i Nazwisko |
Numer grupy |
Data wykonania ćwiczenia |
Data oddania sprawozdania |
OCENA |
|
|
|
|
|
1) Potencjometria
Potencjometryczne metody analityczne oparte są na pomiarach siły elektromotorycznej (SEM), czyli różnicy potencjałów półogniw (elektrod) ogniwa elektrochemicznego, w sytuacji gdy gęstość płynącego przez ogniwo prądu jest znikomo mała. Reakcje elektrodowe przebiegają bez przyłożonego z zewnątrz napięcia.
Metody potencjometryczne wykorzystują zależność miedzy stężeniem (aktywnością) oznaczanego jonu w roztworze a potencjałem elektrody wskaźnikowej zanurzonej w badanym roztworze mierzonym względem elektrody porównawczej (zwanej również elektrodą odniesienia), której potencjał ma wartość stałą.
Metody potencjometrii bezpośredniej polegają na wyznaczeniu stężenia oznaczanego składnika na podstawie wcześniej przygotowanej krzywej kalibracyjnej sporządzonej w oparciu o roztwory wzorcowe lub metodą dodatku wzorca. W potencjometrii pośredniej wykonuje się miareczkowania roztworów i wyznacza zmianę SEM ogniwa spowodowaną dodaniem titranta do roztworu badanego. Następnie wyznacza się punkt końcowy miareczkowania (PKM) i oblicza stężenie oznaczanego składnika.
Potencjał elektrody wskaźnikowej wskazuje, jak stężenia indywiduów w półogniwie różnią się od ich wartości równowagowych. Np. potencjał elektrodowy dla procesu: aA + bB + … + ne ↔ cC + dD + … określa równanie Nernsta:
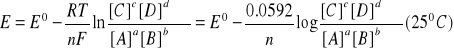
w którym Eº - oznacza standardowy potencjał elektrody wskaźnikowej, charakterystyczny dla każdej reakcji połówkowej, R - stałą gazową 8.314 J·K-1·mol-1; T - temperaturę w kelwinach; n - liczbę elektronów, która pojawia się w zapisie reakcji połówkowej; F - stałą Faradaya równą 96 485 C (kulombów) na mol elektronów; a ln oznacza naturalny logarytm ijest równe 2.303log. [A] - stężenie molowe i a - liczba indywiduów A.
W praktyce analitycznej stosuje się empiryczną postać równania Nernsta i SEM ogniwa składającego się z elektrody wskaźnikowej i elektrody odniesienia można przedstawić:
![]()
w którym E - SEM ogniwa pomiarowego; E* - stała dla danego układu obejmująca standardowy potencjał elektrody wskaźnikowej, potencjał elektrody odniesienia i potencjały dyfuzyjne w układzie pomiarowym; ±(S/n) - nachylenie charakterystyki elektrody; (+) dla kationów i (-) dla anionów; ai - aktywność (stężenie) jonu i. Teoretyczna wartość S = 59.16/n [mV] na dekadę zmiany aktywności (w temp. 25ºC).
W praktyce analitycznej, gdzie poszukuje się informacji o bezwzględnych ilościach oznaczanych substancji, wykreśla się krzywe wzorcowe w układzie E = f(ci) lub stosuje metodę dodatku wzorca. W drugiej metodzie nieznane stężenie jonu „i” wyznacza się na podstawie zmian potencjału elektrody wskaźnikowej wywołanej dodaniem do znanej objętości próbki o nieznanym stężeniu ściśle odmierzonej ilości roztworu wzorcowego.
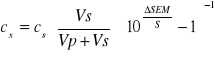
gdzie: cx - stężenie jonu „i” szukane [mol/L]; cs - stężenie jonu „i” w roztworze wzorcowym [mol/L]; Vs - objętość roztworu wzorcowego [mL]; Vp - objętość roztworu próbki [mL]; ΔSEM - zmiana SEM ogniwa wywołana dodatkiem roztworu wzorcowego [mV]; S - nachylenie krzywej kalibracji [mV/log(ci)].
Miareczkowanie potencjometryczne polega na mierzeniu różnicy potencjałów między elektroda wskaźnikową i elektrodą porównawczą po dodaniu każdej porcji odczynnika miareczkującego (titranta). Krzywa miareczkowania potencjometrycznego przedstawia zależność SEM = f(V). W czasie miareczkowania pierwszy odczyt odpowiada dodaniu 0 mL roztworu miareczkującego, następnie - kolejnym porcjom tego roztworu. Zmiany SEM są na początku miareczkowania nieznaczne, ale w miarę zbliżania się do punktu końcowego miareczkowania (PK) stają się coraz większe. Wtedy należy zmniejszyć porcje dodawanego odczynnika. W PK zmiany SEM osiągają maksimum, po czy maleją i odczynnik miareczkujący znowu dodaje się większymi porcjami. Punkt końcowy miareczkowania (PK) można wyznaczyć metodą graficzną, a także z wykresu pierwszej pochodnej, czyli stosunku przyrostu SEM do przyrostu objętości w funkcji objętości titranta a więc zależności (ΔSEM/ΔV) = f(V) lub drugiej pochodnej (Δ2SEM/ΔV2) = f(V).
Przebieg ćwiczeń:
Ćwiczenie 1: Wyznaczenie wartości współczynnika nachylenia S (mV/pH) dla kombinowanej elektrody szklanej w zakresie 1 - 12 pH
Aparatura:………………………………………………………………………………………………….……………………………………………………………………………………………………………………………… ……………………………………………………………………………………………………………………………………………………………………………………………………………………………………..………
Odczynniki:…………………………………………………………………………………………………..…………………………………………………………………………………………………………………………… ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Przebieg ćwiczenia:………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Tabela wyników:
Stężenie kwasu |
0 mol/L |
10-6 mol/L |
10-5 mol/L |
10-4 mol/L |
10-3 mol/L |
10-2 mol/L |
10-1 mol/L |
Wartość SEM [mV] |
|
|
|
|
|
|
|
Stężenie zasady |
0 mol/L |
10-6 mol/L |
10-5 mol/L |
10-4 mol/L |
10-3 mol/L |
10-2 mol/L |
Wartość SEM [mV] |
|
|
|
|
|
|
Wykres zależności:
Wyznaczona wartość współczynnika S …………………………………………………………………
Ćwiczenie 2: Wyznaczenie nieznanego stężenia jonów wodorowych metodą dodatku wzorca
Aparatura:……………………………………………………………………………………………………………….………………………………………………………………………………………………………………
Odczynniki:……………………………………………………………………………………………………...…
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Przebieg ćwiczenia:………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Tabela wyników:
Dodatek wzorca |
0 mol/L |
10-6 mol/L |
10-5 mol/L |
10-4 mol/L |
Wartość SEM [mV] |
|
|
|
|
Wyznaczona wartość stężenia jonów wodorowych:…………………..………………………………………
Ćwiczenie 3: Przykład miareczkowania roztworu kwasu roztworem zasady i wyznaczenie punktu końcowego miareczkowania metodą graficzną oraz pierwszej pochodnej
Aparatura:………………………………………………………………………………………………….……… ……………………………………………………………………………………………………………..………
Odczynniki:…………………………………………………………………………………………………..…… ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Przebieg ćwiczenia:………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Tabela wyników:
Ilość dodanej zasady |
Przyrost objętości zasady |
Wartość SEM odpowiadająca dodanej ilości zasady |
Przyrost SEM odpowiadający przyrostowi objętości |
Wartość pierwszej pochodnej |
V [mL] |
ΔV [mL] |
SEM [mV] |
ΔSEM [mV] |
ΔSEM/ΔV |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Wykresy zależności:
Wyznaczone wartości PK: Metoda I:………………..…………Metoda II……………………………….
Wyznaczone stężenie kwasu………………………………………………………………………………..
Metoda I:………………..……………….Metoda II……………………………….
2) Konduktometria
Konduktometria jest metodą elektroanalityczną polegającą na pomiarze przewodnictwa elektrycznego, G, roztworu elektrolitu znajdującego się pomiędzy dwiema biernymi elektrodami wykonanymi zwykle z platyny pokrytej najczęściej tzw. czernią platynową (silnie rozdrobniona platyna). Zgodnie z drugim prawem Ohma opór, R, przewodnika jest wprost proporcjonalny do jego długości, l, i odwrotnie proporcjonalny do pola powierzchni jego przekroju A:
![]()
[Ω]
gdzie: ρ - opór właściwy [Ω·cm] charakterystyczny dla danego materiału. Jest to opór, jaki dla przepływu prądu stawia przewodnik o długości l = 1 cm i przekroju A = 1 cm2.
W przypadku roztworów elektrolitów zamiast pojęcia oporu elektrycznego używa się pojęcia przewodnictwo elektryczne (konduktancja) G. Jednostką przewodnictwa, G, jest Siemens: S = Ω-1. Podobnie jak w przypadku oporności, materiał charakteryzowany jest opornością właściwą, w przypadku przewodnictwa roztworu elektrolit charakteryzowany jest przewodnictwem właściwym, κ, (konduktywnością).
![]()
[S·cm-1]
jest to przewodnictwo słupa elektrolitu o długości 1 cm i o przekroju 1 cm2. Stosunek k = l/A nazywa się stałą naczyńka konduktometrycznego.
Przewodnictwo roztworu ,G, umieszczonego między dwiema elektrodami o powierzchni, A, znajdującymi się w odległości, l, wyraża równanie:
![]()
[S]
Przewodnictwo właściwe elektrolitu zależy zarówno od stężenia jonów jak i prędkości ich poruszania się w polu elektrycznym. Na prędkość poruszania się jonów mają wpływ: właściwości jonów oraz rozpuszczalnika, stężenie roztworów, temperatura oraz natężenie pola elektrycznego.
Bezpośrednie wyznaczenie przewodnictwa właściwego elektrolitu, G, na podstawie zmierzonej wartości oporu, R, nie jest możliwe. Również konstrukcja detektorów konduktometrycznych nie pozwala określić wartości A oraz l. W praktyce wyznacza się stosunek k = A/l poprzez pomiar oporności elektrolitu, którego przewodnictwo właściwe zostało wyznaczone drogą bezpośrednich, precyzyjnych pomiarów. Najczęściej wykorzystuje się do tego celu wodne roztwory chlorku potasu (KCl) o określonym stężeniu.
Temperatura [ºC] |
Przewodnictwo właściwe, κ, 10-4 [S·cm-1] |
||
|
0.01 mol/L KCl |
0.1 mol/L KCl |
1 mol/L KCl |
15 20 25 |
11.47 12.78 14.13 |
104.8 116.3 128.8 |
925.2 1020.7 1118.0 |
Analiza konduktometryczna to: konduktometria bezpośrednia oraz miareczkowanie konduktometryczne. Konduktometria bezpośrednia polega na pomiarze bezwzględnej wartości przewodnictwa elektrolitów, jednak nie zapewnia selektywnej informacji o zawartości konkretnego jonu. Wskutek niespecyficzności jest stosowana do śledzenia przebiegu procesów chemicznych i detekcji jonów po ich wstępnym rozdzieleniu.
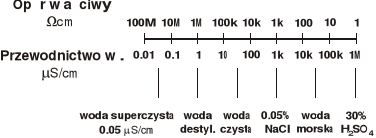
Skala przewodnictwa właściwego dla wody i niektórych roztworów elektrolitów.
Ćwiczenie 4: Wyznaczenie oporu i przewodnictwa właściwego kilku roztworów wzorcowych KCl oraz wybranych próbek wody (destylowanej, wodociągowej, rzecznej, itp.)
Aparatura:………………………………………………………………………………………………….……… ………………………… …………………………………………………………………………………..………
Stała naczynka konduktometrycznego k = ………………………………………………………………..………
Odczynniki:…………………………………………………………………………………………………..…… ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Przebieg ćwiczenia:………………………………………………………………………………………………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Tabela wyników:
Zmierzona temperatura ……………..[ºC] |
Stężenie roztworu KCl |
Próbka wody |
||||
|
0.01 mol/L |
0.1 mol/L |
1 mol/L |
……………... |
……………... |
……………... |
Zmierzona wartość przewodnictwa G [μS] |
|
|
|
|
|
|
Wyznaczona wartość ρ [Ω·cm] |
………. |
………. |
………. |
………. |
………. |
………. |
Wyznaczona wartość κ [μS/cm] |
………. |
………. |
………. |
………. |
………. |
………. |
Ćwiczenie 5: Oznaczenie kwasu solnego (HCl) metodą miareczkowania konduktometrycznego mianowanym roztworem wodorotlenku sodu.
Aparatura:………………………………………………………………………………………………….……… ………………………… …………………………………………………………………………………..………
Stała naczynka konduktometrycznego k = ………………………………………………………………..………
Odczynniki:…………………………………………………………………………………………………..…… ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Reakcja chemiczna:
![]()
Objaśnienie metody konduktometrycznego oznaczania HCl w oparciu o reakcję chemiczną…..………
………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
Opracowanie wyników:……….……………………………………………………………………………..…… ………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………
(Dla każdej objętości roztworu obliczyć poprawkę na zmianę objętości podczas miareczkowania. Poprawkę tę należy obliczyć zgodnie ze wzorem:
![]()
gdzie p - poprawka na zmianę objętości; V1 - objętość roztworu pobranego do miareczkowania [mL]; V2 - objętość odmierzonej wody destylowanej do rozcieńczenia próbki pobranej do miareczkowania [mL]; V3 - objętość dodanego odczynnika miareczkującego (titranta) [mL].
Po wyznaczeniu poprawki obliczyć wartość przewodnictwa, Gp, przez pomnożenie odczytanych wartości, God, przez poprawkę, p. Otrzymuje się wtedy wartości przewodnictwa niezależne od zmiany objętości: Gp = p·God)
Tabela wyników:
Objętość dodanej zasady NaOH [mL] |
Przewodnictwo odczytane, God [μS] |
Obliczona poprawka p |
Poprawiona wartość przewodnictwa, God [μS] |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Wykres krzywej miareczkowania konduktometrycznego Gp = f(VNaOH)
Wyznaczona wartość PK: ……………………………….………………..……………………………….
Wyznaczone stężenie kwasu solnego………………..…………………………………………………..
WNIOSKI KOŃCOWE
…………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………………….
9
Wyszukiwarka
Podobne podstrony:
adg formularz5, Inżynieria środowiska, II semestr, Ch.a.i
adg formularz4, Inżynieria środowiska, II semestr, Ch.a.i
adg wyklady, Inżynieria środowiska, II semestr, Ch.a.i
adg harmonogram, Inżynieria środowiska, II semestr, Ch.a.i
adg spiscwiczen, Inżynieria środowiska, II semestr, Ch.a.i
grafika (1), Inżynieria środowiska, II semestr, PGI
3O lasach, Inżynieria środowiska, II semestr, POŚ
instrukcja - HYDROLIZA SOLI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
pHmetr-instrukcja obsługi, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
instrukcja - CHEMIA ORGANICZNA II, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratori
anemometr, Inżynieria środowiska, inż, Semestr II, Meteorologia z elementami klimatologii, laborator
Program L1chog30d, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
Podział kationów Lipiec Szmal, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
Wiatromierz Wilda, Inżynieria środowiska, inż, Semestr II, Meteorologia z elementami klimatologii, l
Kationy 4 i 5 tabelki, Inżynieria środowiska, inż, Semestr II, Chemia ogólna
instrukcja - TYPY REAKCJI CHEMICZNYCH, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, labora
instrukcja - REAKCJE UTLENIANIA I REDUKCJI, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, l
instrukcja - ROZTWORY BUFOROWE, Inżynieria środowiska, inż, Semestr II, Chemia ogólna, laboratorium
więcej podobnych podstron