Egzamin z Chemii semestr II
UWAGA! Są błędy w schematach węglowodorów!!!
Termin 0
Zdefiniuj pojęcie funkcji stanu. Przedstaw pojęcie entalpii jako funkcji stanu.
Funkcja termodynamiczna jest parametrem układu posiadającym określoną wartość dla danego stanu układu., niezależnie od drogi na jakiej dany stan układu został osiągnięty. Dzięki temu liczbowe wartości odnoszące się do funkcji termodynamicznej można dodawać i odejmować. Suma algebraiczna wartości tych funkcji przedstawia odpowiednio ich zmianę. Funkcjami termodynamicznymi są: energia wewnętrzna, entalpia układu, entropia i energia swobodna.
Jeżeli poza pracą zmiany objętości żadna inna forma energii nie jest wymieniana z otoczeniem, to przy oziębianiu lub ogrzewaniu układu pod stałym ciśnieniem ciepło pobrane lub wydzielone w czasie procesu odpowiada zmianie entalpii układu. Ponieważ większość procesów chemicznych przeprowadza się pod stałym ciśnieniem atmosferycznym w otwartych więc (?) entalpia jest funkcją termodynamiczną mającą bardzo duże zastosowanie w chemii. W odniesieniu do reakcji chemicznych entalpia jest niczym innym jak ciepłem reakcji pod stałym ciśnieniem. Założono, że entalpia molowa substancji prostej, trwałej w temp. 25oC i pod ciśnieniem 1 atmosfery jest równa zeru. Zmiana entalpii reakcji to różnica pomiędzy sumą ciepła tworzenia produktów reakcji, a sumą ciepła tworzenia substratów reakcji.
Jeżeli w układzie przebiega reakcja egzotermiczna, w której wydziela się ciepło Q (dodatnie) i równocześnie ciepło to zostaje przekazane z układu do otoczenia to zgodnie z termodynamiczną konwencją znaków ma ono wartość ujemną i jest nazywane zmianą entalpii układu (ΔH) lub entalpia reakcji.
Funkcją stanu nazywamy wielkość fizyczną, której wartość zależy wyłącznie od stanu w jakim układ aktualnie się znajduje nie zaś od drogi po której do tego stanu doszedł.
Entalpia - wielkość równa ciepłu wymienionemu przez układ i otoczenie.
H2O(s)→H2O(c) ΔH= 6,01 kJ
H2O(c)→H2O(s) ΔH=-6,01 kJ
Zdefiniuj pojęcie entropii. Jak różni się zmiana entropii w przemianie odwracalnej i rzeczywistej?
Entropia to miano nieuporządkowania. Np. sieć krystaliczna w temp. 0 K to układ doskonale uporządkowany i dlatego entropia = 0. Entropia zależy od temperatury i wraz z nią wzrasta.
Całkowita entropia układu jest równa:
gdzie k to stała Boltzmanna, a W - liczba sposobów na jaki stan termodynamiczny układu może być zrealizowany. Zatem
log2(W) = ln(W) / ln(2)
Oblicz entalpię reakcji:
/słabo odbite, zamiast (s) może być g lub 5 /
C2H4 (s) ÷ H2 (s) - C2H6 (s)
mając dane entalpię spalania poszczególnych reagentów:
etenu - 1409 kJ/mol
etanu - 1557 kJ/mol
wodoru - 285.8 kJ/mol
podaj prawo z jakiego korzystasz.
Korzystamy z prawa Hessa. Jest ono konsekwencją pierwszej zasady termodynamiki w odniesieniu do reakcji chemicznych. Substraty i produkty reakcji mają ściśle określoną zawartość ciepła zwaną entalpią (∆H). Znając entalpię reakcji można obliczyć ciepło reakcji.
∆H = Hproduktów - Hsubstratów
∆H = 1557 - (1409 + 285,8) [kJ/mol] = -137,8 [kJ/mol]
Zdefiniuj pojęcie szybkości reakcji chemicznej. Podaj jaka będzie szybkość zmiany stężenia wszystkich związków chemicznych w przypadku reakcji zachodzącej według schematu:
k1 B
A
k2 C
Jaki to typ reakcji złożonej?
Reakcja równoległa, szybkość powst. prod. B i C jest proporcjonalna do st. szybkości k1 i k2.
Szybkość reakcji chemicznej to ubytek stężenia substratów reakcji lub przyrost stężenia produktów reakcji wyrażony w molach na litr, w małym odstępie czasu. V = -![]()
. Szybkość reakcji typu A→ (r. rozkładu) zależy tylko od stężenia substratu.
W reakcji hydrolizy sacharozy przebiegającej przy dużym nadmiarze wody stężenie sacharozy spadło z 2 mol/dm3 do 1 mol/dm3 w czasie t. Podaj stężenie sacharozy po czasie 2t. Co powiesz na temat rzędowości tej reakcji?
![]()
![]()
![]()
![]()
![]()
Podaj kryterium podziału reakcji chemicznych na odwracalne i nieodwracalne. Na podstawie wybranego przykładu wytłumacz pojęcie stałej równowagi reakcji. Jakie czynniki wpływają na równowagę reakcji?
A czy to przypadkiem nie jest w skrypcie?
Reakcja odwracalna- jeżeli istnieje odwrotna do niej reakcja, w której:
-zmienne charakteryzujące stan układu będą przechodzić przez te same stany pośrednie
- wymiana ciepła, pracy z otoczeniem ma takie same wielkości. Po zajściu procesów nie ma śladu.
Reakcja nieodwracalna- wymaga zmian, aby powrócić do stanu początkowego.
Omów zjawisko przenoszenia prądu przez elektrolity oraz zależność przewodnictwa właściwego roztworu od stężenia elektrolitu. Czym wytłumaczysz opisywane zjawisko?
Zdolność przewodzenia prądu nazywamy przewodnictwem, zaś ciała które tę zdolność posiadają - przewodnikami. Przewodniki I rodzaju przewodzą prąd elektronowo - należą do nich przede wszystkim metale i ich stopy. Przewodniki II rodzaju przewodzą prąd za pośrednictwem jonów, stąd takie przewodnictwo nazywa się elektrolitycznym
Gdy do roztworu elektrolitu zanurzamy elektrody połączone ze źródłem prądu stałego, wówczas na poruszające się chaotycznie, we wszystkich kierunkach jony oddziałuje pole elektryczne. W polu elektrycznym ten chaotyczny ruch jonów zmienia się w uporządkowany w kierunku odpowiednich elektrod. Wskutek tzw. migracji jonów wzrasta po pewnym czasie w pobliżu katody stężenie jonów dodatnich, a w pobliżu anody - jonów ujemnych.
Elektrolity są to substancje ulegające po rozpuszczeniu lub roztopieniu dysocjacji elektrolitycznej (rozpadowi na jony). Elektrolitami są wszystkie kwasy, zasady i sole. Związki te w stanie stałym zbudowane są z jonów (np. NaCl, KNO3, CaF2, NaOH). Stopione lub rozpuszczone w roztworach przewodzą prąd elektryczny. Nośnikami ładunku elektrycznego są jony. Najczęściej stosowanymi roztworami elektrolitów są roztwory wodne.
Cząsteczki elektrolitu z chwilą przejścia do roztworu rozpadają się samorzutnie na jony. Jeżeli przez roztwór wodny elektrolitu będziemy przepuszczać stały prąd elektryczny to nastąpi zjawisko zwane elektrolizą polegające na zachodzeniu reakcji chemicznej kosztem prądu elektrycznego.
Na anodzie (+) zachodzi przemiana anionów w obojętne atomy lub rodniki (aniony oddają e- anodzie), a na katodzie (-) zachodzi proces pobierania przez kationy ładunków ujemnych przez co zamieniają się one w atomy .obojętne . przepływ prądu elektrycznego w roztworze podczas elektrolizy związany jest z ruchem jonów w polu elektrycznym.
Przewodnictwo właściwe jest odwrotnością oporu właściwego.
Przewodnictwo właściwe roztworu mocnego elektrolitu jest zależne od stężenia. Ze wzrostem stężenia przewodnictwo wzrasta, gdyż wzrasta stężenie jonów w roztworze. Po przejściu pewnego maksimum przewodnictwo właściwe maleje, gdyż przy dalszym wzroście stężenia maleje ruchliwość jonów.
Omów krótko półogniwa gazowe. Na konkretnym przykładzie podaj schemat, reakcję zachodzącą na tym półogniwie oraz wzór na jego potencjał.
Półogniwo gazowe I rodzaju- półogniwo wodorowe- elektroda platynowa pokryta czernią platynową zanurzona w roztworze kwasu i opłukiwana gazowym wodorem 2H3O++2e-<>H2+2H2O
Fazy metaliczne ogniw, graniczące z elektrolitem noszą nazwę półogniw lub elektrod. Czasem zamiast fazy metalicznej stosuje się inne przewodniki (np. grafit) lub układy faz (np. metale opłukiwane strumieniem gazu). W praktyce półogniwo oznacza układ, w którym zachodzi pół reakcji, czyli proces opisany jonowo-elektronowym równaniem połówkowym.
Istnieją również ogniwa, w których reakcja elektronowa przebiega z udziałem anionów niemetali. Na rysunku jest przedstawiony schemat ogniwa gazowego, w którym zachodzi reakcja sumaryczna:
H2+Cl2→2HCl(aq)
Schemat ogniwa gazowego Pt,H2│H+,Cl-│Cl2,Pt.
Elektrodami są blaszki platynowe opłukiwane strumieniami gazów; lewa zasilana wodorem stanowi biegun ujemny, prawa zasilana chlorem- biegun dodatni. Na anodzie zachodzi przemiana wodoru w jony wodorowe: H2-2e-→2H+ , H2→2H++2e-.
Uwolnione elektrony przekazywane są blaszce platynowej i przez zewnętrzny obwód wędrują na katodę, gdzie redukują chlor do jonów chlorkowych: Cl2+2e-→2Cl-
Blaszki platynowe spełniają pomocniczą rolę przekaźnika elektronów. W momencie gdy stężenie powstającego kwasu solnego przekroczy rozpuszczalność chlorowodoru w wodzie rozpoczyna się ulatnianie gazowego HCl z roztworu. Półogniwo wodorowe połączone przewodnikiem z półogniwem chlorowym jest urządzeniem w którym przebiega synteza HCl, mimo, że cząstki substratów (H2 i Cl2) nie zderzają się ze sobą.
Podaj reakcje elektrodowe zachodzące podczas elektrolizy stopionego NaCl i wodnego roztworu NaCl.
2Na++2e-→2Na 2H2O+2e-→H2+2OH-
2Cl-→2e-+Cl2 2Cl-→Cl2+2e-
stopiony NaCl wodny roztwór NaCl
2NaCl→2Na+Cl2 2NaCl+2H2O→H2+Cl2+2NaOH
Co to jest izomeria i jakie są jej rodzaje? Odpowiedź zilustruj przykładami.
Izomery to związki zawierające tą samą liczbę tych samych atomów. Za każdym razem połączonych w inny sposób. Izomeria jest zjawiskiem ogólnym wśród związków organicznych. Mimo identyfikacji wzoru sumarycznego izomery różnią się prawie wszystkimi właściwościami fizycznymi i chemicznymi.
Wyróżniamy typy izomerii:
Łańcuchowa
Położenia
-różne położenie chlorowca lub wiązania wielokrotne
- w chloroalkanach, alkenach, chloroalkenach, aldechydach, ketonach
C3H7Cl Np.
Geometryczna
-warunek wiązanie podwójne
cis- gdy cięższe podstawniki są po tej samej stronie płaszczyzny wiązania Π
trans- odwrotnie
np.
Tautometryczna
-polega na przekształceniu się wiązania pi (r. addycji do wiąz. Π)
np. acetylen ![]()
(etanol) →
W etanolu wiąz Π przechodzi na tlen samorzutnie na skutek drgań cząsteczki
Podaj przykład reakcji addycji zgodnej i przeciwnej regule Markownikowa.
Reguła Markownikowa: w reakcji przyłączania cząsteczek niesymetrycznych (np. HCl) do niesymetrycznych alkenów (np. CH2=CH-CH3) elektrododatni składnik cząsteczki przyłączającej się (najczęściej jest to wodór) atakuje atom węgla związany z większą liczbą atomów wodoru.
CH2=CH+CH3 + H-OH kat. CH3-CH-CH3
OH
Sposoby otrzymywania i właściwości chemiczne kwasów karboksylowych.
Wzór ogólny: CnH2n+1COOH
Grupa COOH nosi nazwę grupy karboksylowej.
Słabe kwasy karboksylowe dysocjują w roztworze wodnym
Reagują z zasadami: 2CH3COOH + Ca(OH)2 (CH3COO)2Ca + 2H2O
Reagują z metalami: 2CH3COOH + 2Na 2CH3COONa + H2
Reagują z tlenkami zasadowymi, metalami nieszlachetnymi
Reagują z alkoholem dając estry
Istota oznaczeń kolorymetrycznych.
Spektrofotometria absorpcyjna opiera się na selektywnej absorpcji promieniowania świetlnego przez roztwór badanej substancji. Spektrofotometrię w świetle widzialnym określa się tradycyjną nazwą - kolorymetrią. Kolorymetria polega na wizualnym porównywaniu intensywności barwy roztworów. W nowoczesnej kolorymetrii już nie porównuje się zabarwienia, lecz mierzy się absorpcję roztworów. Każde oznaczenie kolorymetryczne składa się z dwóch niezależnych etapów:
otrzymywanie barwnego połączenia, zawierającego oznaczany pierwiastek lub składnik
pomiar absorpcji światła przez roztwór tego związku
Mając roztwór badanej substancji można oznaczyć jego absorpcję różnymi sposobami za pomocą różnych przyrządów.
Według sposobu wykonywania pomiaru absorpcji, dzielimy metody kalorymetryczne na wizualne i fotoelektryczne - a fotoelektryczne jeszcze na fotokolorymetryczne jeśli przyrząd pomiarowy zaopatrzony jest w filtry świetlne i spektrofotometryczne, jeśli pomiary absorpcji przeprowadza się dla światła monochromatycznego. / nie wiem, czy to „jeśli” odnosi się do dzielenia metod kalorymetrycznych - ogólnie, czy może tylko do dzielenia fotoelektrycznego /
Omów równowagę ciecz-para w układach jedno- i wieloskładnikowych.
Równowaga o charakterze dynamicznym- tyle samo cząsteczek z fazy ciekłej przejdzie do fazy gazowej co w tym samym czasie z gazowej do ciekłej, a szybkości obu procesów zrównają się.
Równanie Clausiusa-Clapeyrona: ![]()
(H- ciepło molowe parowania, V-objętość pary i cieczy, T-temperatura parowania)
Prawo Raoulta- Cząstkowa prężność pary danego składnika nad roztworem równa się prężności nad czystym roztworem pomnożonej przez ułamek molowy tego składnika w roztworze; opisują to równania: pA=pA0xa i pb=pB0xB
p=pA+pB
Co to są grupy auksochromowe i batochromowe?
Pod wpływem zmian strukturalnych cząsteczek, np.: przez wprowadzanie do nich dodatkowego podstawnika, barwa substancji może ulec zmianie. Podstawniki przesuwające absorpcję w stronę fal dłuższych nazywamy auksochromowymi, natomiast te podstawniki, które zachowują się odwrotnie nazywamy batochromowymi. Najbardziej typowym przykładem auksochromów są podstawniki I rodzaju. Zawierają one z reguły atom dysponujący wolną parą elektronową sprzężoną z układem elektronów (?) aromatycznych. Do najpospolitszych należą grupy -OH, -NH2, -OCH3, NHCH3, -N(CH3)2. /to jest jakoś dziwnie opracowane /
Termin 1
Zdefiniuj pojęci funkcji stanu. Podaj sposób obliczania entropii molowej czystej substancji.
Patrz pytanie 1 termin 0
Podaj treść pierwszej zasady termodynamiki i jej postać w przypadku różnych przemian.
Energia wewnętrzna układu zamkniętego nie zmienia się, niezależnie od przemian zachodzących w tym układzie.
Entalpia reakcji C + O2 +CO2 wynosi -394 kJ/mol, natomiast reakcji CO + ½ O2 = CO2 wynosi -298 kJ/mol (podane wartości entalpi odnoszą się do temperatury 298 K). Oblicz entalpię reakcji: C + ½ O2 = CO2. Podaj prawo z jakiego korzystasz.
Co to jest rzędowość i cząsteczkowość reakcji? Podaj równanie kinetyczne oraz wyprowadź na stałą szybkości reakcji dla reakcji 2 rzędu typu: A + B = C
Rząd reakcji
Jeżeli a = 1, to reakcja jest pierwszego rzędu względem A; jeżeli a = 2, to reakcja jest drugiego rzędu względem A itp.
Cząstkowe rzędy reakcji, tylko wyjątkowo - np. dla reakcji elementarnych - przyjmują wartości równe współczynnikom stechiometrycznym tych reagentów.
Sumaryczny rząd reakcji
Sumaryczny rząd reakcji chemicznej - jest to suma wykładników potęgowych w równaniu szybkości reakcji chemicznej
( rząd reakcji = a + b + c + .....)
Cząsteczkowość reakcji definiuje liczba cząsteczek biorących udział w najwolniejszym stadium reakcji. Zwykle równa rzędowości reakcji, natomiast nie jest słuszne stwierdzenie odwrotne.
Cząsteczkowość i rząd reakcji wyznacza się tylko eksperymentalnie, nie można obliczyć ich teoretycznie.
Sumaryczny rząd reakcji jest przeważnie liczbą niecałkowitą, co oznacza, że reakcja przebiega przez etapy pośrednie, z których nawolniejszy decyduje o sumarycznym rzędzie reakcji.
Na ogół rząd reakcji jak i cząsteczkowość są z reguły małymi liczbami nie przekraczającymi wartości 3.
Zagadnienie sprowadza się do tego, że równoczesne zderzenia większej liczby cząsteczek są mało prawdopodobne a na sumaryczną szybkość reakcji wpływa przede wszystkim najpowolniejszy etap pośredni bedący przemianą elementarną i dlatego rząd reakcji jest małą liczbą.
Scharakteryzuj reakcje złożone. Podaj odpowiednie przykłady.
Rodzaje reakcji złożonych
reakcje addycji - czyli inaczej reakcje dodawania - w wyniku tej reakcji reagująca cząsteczka ulega powiększeniu o jakiś atom lub grupę atomów. Np: Do cząsteczki etylenu (CH2=CH2) zostaje przyłączona cząsteczka bromowodoru (HBr) w wyniku czego powstaje nowa cząsteczka bromoetanu BrCH2-CH3
reakcje substytucji - czyli inaczej reakcje podstawienia - w wyniku tej reakcji w cząsteczce następuje wymiana jakiegoś atomu lub ich grupy. Jeden atom lub ich grupa odrywa się od cząsteczki a inny atom lub ich grupa się w to miejsce przyłącza
reakcje eliminacji - czyli inaczej reakcje oderwania - w wyniku tej reakcji od cząsteczki odrywa się jakiś atom lub grupa atomów i nic innego się w to miejsce nie przyłącza
Podaj regułę przekory i na jej podstawie przedstaw wpływ różnych czynników na równowagę reakcji.
Reguła przekory lub przeciwdziałania to reguła dotycząca układów w stanie równowagi. Jeżeli układ znajduje się w stanie równowagi i zostanie poddany działaniu czynnika zewnętrznego (np. sprężaniu, ogrzaniu) to w układzie zajdą takie zmiany, które zmniejszą wpływ tego czynnika. Np. w przypadku gdy zwiększymy ciśnienie w układzie reagującym znajdującym się w stanie równowagi to wówczas w tym układzie reakcja przebiegnie w takim kierunku, aby ciśnienie się zmniejszyło. W przypadku gdy dostarczymy do układu ciepło, reakcja przebiegnie w takim kierunku aby część ciepła została pochłonięta. Temperatura wówczas wzrośnie o mniejszą wartość niżby to miało miejsce, gdyby stan równowagi się nie przesunął.
Zdefiniuj przewodnictwo równoważnikowe. Jakie znasz sposoby wyznaczania tej wielkości?
Przypomnienie: przewodnictwo właściwe to przewodnictwo sześciennej kostki roztworu elektrolitu o boku 1m. Oznacza się je litera kappa i jest ono odwrotnością oporu właściwego.
Wielkością, która lepiej niż przewodnictwo właściwe charakteryzuje elektrolit jest tzw. przewodnictwo równoważnikowe - jest to przewodnictwo takiej objętości V roztworu, w której zawarty jest 1 gramorównoważnik elektrolitu między dwiema równoległymi elektrodami o powierzchni S, oddalonymi od siebie o 1m. Oznacza się je literą lambda.
λ=κV lub λ=κ/c
/wykresy są na stronie 78/
Wartość przewodnictwa równoważnikowego charakteryzuje zdolność 1 gramorównoważnika elektrolitu do przewodzenia prądu elektrycznego. W miarę wzrostu stężenia elektrolitu - niezależnie od jego rodzaju - obserwuje się spadek przewodnictwa równoważnikowego, w miarę zaś rozcieńczania przewodnictwo rośnie dążąc do pewnej wartości granicznej - przewodnictwa równoważnikowego granicznego. Przewodnictwo to charakteryzuje roztwór elektrolitu o stężeniu nieskończenie małym. Zgodnie z równaniem Kohlrauscha zależność przewodnictwa równoważnikowego od przewodnictwa granicznego i stężenia przedstawia się tak: ![]()
gdzie: λ - przewodnictwo równoważnikowe, λ0 - przewodnictwo graniczne, c - stężenie elektrolitu, a - stała empiryczna zależna od rodzaju elektrolitu
Na przykładach omów półogniwa I rodzaju (schemat, reakcje, potencjał).
Metaliczne I rodzaju:
Zbudowane najczęściej z litego metalu zamurzonego w roztworze swych jonów, reakcja połówkowa dla takiego ogniwa: ![]()
natomiast schemat: ![]()
. Potencjał takiego ogniwa zależy od aktywności jonów zgodnie ze wzorem: ![]()
(gdy z czystego metalu to a=1). Typowe półogniwa tego typu: CuICu2+ AgIAg+ ZnIZn2+
Gazowe I rodzaju
Półogniwo gazowe I rodzaju- półogniwo wodorowe- elektroda platynowa pokryta czernią platynową zanurzona w roztworze kwasu i opłukiwana gazowym wodorem 2H3O++2e-<>H2+2H2O. Potencjał takiego ogniwa zależy od ciśnienia gazu ponieważ ich aktywność łatwiej jest wyrazić za pomocą ich prężności 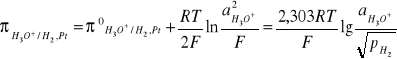
Jakie procesy zachodzą podczas elektrolizy wodnego roztworu kwasu?
Elektroliza wodnego roztworu kwasu
Podczas elektrolizy kwasów z reguły przy katodzie wydziela się wodór, a przy anodzie tlen lub inne produkty (np. Cl2 przy HCl).
Roztwory kwasów tlenowych (H2SO4, H3PO4, HNO3, H2CO3) dają zawsze tlen i wodór.
Jeżeli mamy do czynienia z roztworami rozcieńczonych kwasów, reakcje zachodzące w roztworze mają przebieg taki sam jak dla rozcieńczonych roztworów soli (patrz reakcje elektrodowe dla rozcieńczonych roztworów soli).
W przypadku większych stężeń na katodzie mamy do czynienia z reakcją
2H+ + 2e- --> H2 (powstaje wodór)
a na anodzie produktem utlenienia anodowego w przypadku anionów kwasów tlenowych jest tlen dostarczany przez jony OH- lub cząsteczki wody a w przypadku kwasów beztlenowych utlenieniu ulegają aniony reszt kwasowych (2Cl- --> Cl2 + 2e-) z wydzieleniem produktu np. chloru.
Elektroliza zasad
Jeżeli poddaje się elektrolizie bardzo rozcieńczony roztwór zasady, a do elektrod nie przyłoży się z zewnętrznego źródła prądu zbyt dużego napięcia, to rozkładowi ulega głównie woda; w wyniku reakcji katodowej
2H2O + 2e- --> 2OH- + H2
i wydziela się wodór, natomiast w wyniku reakcji anodowej
H2O --> 2H+ + 1/2O2 + 2e-
wydziela się tlen, przy czym objętość tworzącego się wodoru jest dwukrotnie większa od objętości tworzącego się tlenu (w tych samych warunkach)
W przypadku roztworów stężonych proces anodowy jest następujący;
2OH- --> H2O + 1/2O2 + 2e-
Co to jest izomeria i jakie są jej rodzaje. Podaj wszystkie izomery pentanu.
C5H10
Łańcuchowa
Geometryczna
Wytłumacz na przykładach regułę Zajewa.
W reakcjach odczepiania wody od alkoholi lub chlorowcowodorów od chlorowcowodorów atom wodoru odczepia się od tego z sąsiednich atomów węgla, który jest najuboższy w wodór. Oznacza to, że atom wodoru związany z trzeciorzędowym atomem węgla jest bardziej reaktywny niż atom wodoru związany z drugorzędowym atomem węgla, a ten przewyższa aktywnością atomy wodoru związane z pierwszorzędowym atomem węgla. Wykorzystując regułę Zajcewa można więc przewidywać produkty reakcji eliminacji.
W przypadku, gdy odczepione w reakcji eliminacji grupy znajdują się w różnych położeniach cząsteczki można przewidywać powstanie alkenów o różnej budowie.
Np. podczas odwodnienia pentanolu-2 odczepieniu może ulec atom wodoru z położenia 1 lub z położenia 3.
Dając w wyniku reakcji penten-1 lub penten-2. W rzeczywistości głównym produktem odszczepienia wody z cząsteczki pentanolu-2 jest penten-2.
W przypadku 2-metylopentanolu-3 odszczepienie wodoru zachodzi z położenia 2 i powstaje 2-metylopenten-2.
Sposoby otrzymywania i właściwości chemiczne estrów i eterów.
Estry są związkami powstającymi przez eliminację cząsteczki wody w reakcji alkoholu z kwasem. Jeżeli w reakcji estryfikacji bierze udział alkohol i kwas nieorganiczny otrzymuje się ester nieorganiczny, natomiast gdy ester powstaje z alkoholu i kwasu organicznego mówimy o estrze organicznym.
*reakcje powstawania estrów
Ogólna metoda otrzymywania estrów polega na reakcji kwasów z alkoholami.
C2H5OH+HO-NO2→C2H5-O-NO2+H2O (nieorganiczny)
R-CH2OH+HOOCR'→
-CH2R+H2O (organiczny)
alkohol + kwas → ester + woda
Zamiast kwasów w reakcji estryfikacji można używać ich soli, bezwodników i chlorków kwasowych, a zamiast alkoholi również halogenków alkilowych.
Obojętne estry kwasów nieorg. i org. są związkami niejednolitymi, ich rozpuszczalność wodzie jest na ogół mała, a roztwory wodne nie przewodzą prądu elektr. Niższe astry są cieczami, które można destylować bez rozkładu.
Wzór chem. estru organicznego:
R - węglowodorowy rodnik kwasu
R' - węglowodorowy rodnik alkoholu
Nazwy estrów wywodzą się z nazw kwasów z dodaniem nazwy węglowodoru rodnika alkoholowego estru. I tak, ester etylowy kwasu octowego nosi nazwę octan etylu, ester dwumetylowy kw. siarkowego to siarczan dwumetylu.
Etery o wzorze ogólnym R - O - R' są alkilowymi lub anylowymi pochodnymi wody, lub pochodnymi alkoholu, z których się je zazwyczaj otrzymuje.
Jeżeli obydwa rodniki R są identyczne, eter nazywamy prostym lub symetrycznym, a jeżeli są różne - mieszanym lub niesymetrycznym.
CH3 - O - CH3 eter prosty (symetryczny)
CH3 - O - CH2 - CH3 eter mieszany (niesymetryczny)
Etery są izomeryczne z alkoholami, a ponadto wykazują izomerię łańcuchową,
Np. izomeryczny z alkoholem butylowym eter o wz. sumar. C4H10O może występować jako symetryczny eter dwuetylowy lub niesymetryczny eter metylopropylowy CH3 - O - CH2 - CH2 - CH3. ten rodzaj izomerii, polegającej na różnorodności rodników wyst. w cząsteczkach (np. eterów) o takim samym składzie pierwiastkowym nosi nazwę metamerii. Etery, dwuetylowy i metylp???ropylowy są więc metamerami.
Etery proste powstają przez odwodnienie alkoholi;
Jako środka odwadniającego używa się stężonego kwasu siarkowego.
Metodą mającą ogólne zastosowanie do otrzymywania eterów, zarówno prostych jak i mieszanych, jest tzw. Synteza Williamsona. Polega ona na reakcji pomiędzy odpowiednimi alkoholanami i halogenami alkilowymi:
R - O - Na + R'X → R - O - R' + NaX
Dany alkohol można zamienić w odpowiedni eter symetryczny przez zamianę jednej części alkoholu w pochodna sodową, a z drugiej w odpowiedni bromek lub jodek i przeprowadzenie reakcji między tymi dwoma składnikami.
CH3-CH2-ONa+I-CH2-CH3→
Etery maja właściwości zasadowe, są doskonałymi rozpuszczalnikami tłuszczów i innych substancji organicznych, stosuje się je jako rozpuszczalniki do ekstrakcji.
Nazwy zwyczajowe eterów wywodzą się ze słowa eter i nazwy alkilów, np. eter dwumetylowy CH3-O-CH3, eter metylowoetylowy CH3- O-CH2-CH3 itd.
Racjonalne nazwy eterów wywodzą się z nazwy węglowodorów z przedrostkiem alkoksy. Nazwy tych grup uzyskujemy zastępując końcówkę -yl w nazwie rodnika węglowodorowego końcówka -oksy.
CH3-O- CH3-CH2-O-
metoksy etoksy
Estry kwasów karboksylowych sa cieczami o przyjemnych na ogół zapachach. W wodzie są nierozpuszczalne. Estry kw. nieorg. są również cieczami o ostrych raczej przykrych zapachach. Są na ogół silnie trujące, czasem wybuchowe (azotany0. Maja znaczenie jako środki szeregu syntez organicznych.
Szereg estrów niższych i średnich kw. tłuszcz. Wyst. w przyrodzie w postaci natur. Olejków wonnych. Estry wyższych kwasów i wyższych alkoholi stanowią grupę stałych substancji zwanych woskami. Estry wyższych kw. jednokarboksylowych i alkoholu trójwodorotlenowego - gliceryny, tzw. glicerydy stanowią ogromną grupę substancji naturalnych zwanych tłuszczami.
Najważniejsza reakcją jakiej ulegają estry z dużą łatwością jest reakcja hydrolizy. Estry stosuje się do otrzymywania amidów kwasowych i aldehydów, ketonów, alkoholi i innych substancji organicznych.
Podaj sposób wyznaczania współczynników izotermy adsorpcji Freundlicha.
Adsorpcja - gromadzenie się substancji rozpuszczonych w cieczy lub obecnych w fazie gazowej na powierzchni ciała stałego lub cieczy. Ciało, na którego powierzchni zachodzi adsorpcja nazywa się adsorbentem, a substancję zaadsorbowaną adsortatem. Zależność ilości zaadsorbowanej substancji od jej stężeniaw cieczy lub ciśn. W gazie określona w ustalonej temp. nosi nazwę izotermy adsorpcji ciepło wywiązane w procesie adsorpcji nosi nazwę ciepła adsorpcji.
Izoterma Freundliera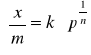
- oparta jest na danych doświadczalnych, opisuje dobrze fakty doświadczalne obserwowane w zakresie średnich ciśnień. I.F. wyraża zależność między masą zaadsorbowanej substancji (x), masą adsorbenta (m) i stałymi charakterystycznymi dla układu i temp. (k, n), przy czym n jest ≥1.
Omów budowę cząstki koloidalnej.
Koloidy są to układy dwu lub wieloskładnikowe o odpowiednim stopniu rozdrobnienia. Składnik tworzący fazę ciągłą układu nazywa się ośrodkiem rozpraszającym (ośr. dyspersyjnym), pozostałe składniki tworzą fazę rozproszoną, czyli zdyspergowaną(??????.)
Średnica cząsteczek substancji rozpuszczonej w roztworze rzeczywistym jest w przyliżeniu równa średnicy cząsteczek rozpuszczalnika i wynosi od 10-7 do 10-8 cm. Średnica cząstek lub cząsteczek składnika rozproszonego w ukł. koloidowym wynosi od 10-5 do 10-7cm. Cząstki o tej średnicy nazywamy cząstkami koloidowymi. Z kolei zawisiny zawierają cząstki o średnicy powyżej 10-5 cm. Układy koloidowe złożone z cząstek o jednakowej średnicy nazywamy układami izodyspersyjnymi, o różnych średnicach polidyspersyjnymi. Spotykane w przyrodzie układy koloidowe maja najczęściej charakter polidyspersyjny.
Ze względu na zachowanie się cząstek koloidoweych w stosunku do fazy rozpraszającej, układy koloidowe i koloidy można podzielić na liofobowe i liofilowe. Jeżeli cząstki fazy rozproszonej łączą się z cząsteczkami ośrodka dyspersyjnego, koloid nazywamy liofilowym. Zjawisko łączenia się cząstek fazy rozproszonej z ośrodkiem dyspersyjnym nazywa się ogólnie solwatacją, a w przypadku ośrodka wodnego hydratacją. Do koloidów liofilowych należą białka, kanina, żelatyna i innne związki organiczne.
Do koloidów liofobowych należą zole metali, soli metalicznych i wodorotlenków metali.
Struktura cząstek koloidów liofobowych jest nieco odmienna od str.cz.k. liofilowych. Cząstki substancji, tworzącej zol liofobowy wykazują tendencje do adsorbowania z roztworu jonów posiadających wymiary zbliżone do parametrów sieci krystalicznej. Są to z reguły jony takie, jakie mogą wytworzyć wiązania z atomami powierzchniowymi. Dzięki elektrostatycznemu przyciąganiu pewna ilość jonów o ładunku przeciwnym osadza się także na powierzchni cząstek, łączny ich ładunek jest jednak mniejszy niż jonów zdolnych do uprzywilejowanej adsorpcji. Tworzy się w ten sposób warstwa jonów ściśle przylegających do powierzchni cząstki koloidalnej. Pozostała część przeciwjonów znajduje się w roztworze i tworzy warstwę wewnętrzną. Rysunek* przedstawia model cząstki koloidowej posiadającej w warstwie wewn. Przewagę ładunków ujemnych. Rysunek** przedstawia model cząstki o przewadze ładunków dodatnich. Linia ciągłą w obu przypadkach oznaczono powierzchnie graniczną między ruchomą i nieruchoma warstwą jonów. Jednoimienny nabój cząstek koloidowych danego układu jest czynnikiem stabilizującym go, możliwość selektywnej adsorpcji jonów jest równocześnie warunkiem powstawania zolu. Znak ładunku elektr. cz. Koloidowych tworzonych przez daną substancją zależy od warunków, w jakich tworzy się układ koloidowy.
Podaj podstawy procesu fotograficznego.
Proces fotograficzny- całokształt procesów przebiegających w emulsji fotograficznej, prowadzących do powstania trwałego obrazu. Można wyróżnić trzy etapy:
a)proces fotochemiczny, powstanie pod wpływem....
Termin 2
Co to jest potencjał termodynamiczny i jakie jest jego znaczenie w chemii?
Potencjał termodynamiczny (entalpia swobodna, p.t. dla stałego ciśnienia); funkcja termodynamiczna, charakteryzująca stan układu. Zaznacza się ją zazwyczaj symbolem G przy czym:
ΔG=ΔH-TΔS
H - entalpia układu
S - entropia układu
T - temperatura bezwzględna
Samorzutne procesy izotermiczne i izobaryczne biegną zawsze w kierunku zmniejszenia wartości p.t.
Entalpia - termodynamiczna funkcja stanu, określona zależnością
ΔH = ΔU + pV ?
U - energia wewnętrzna (energia układu związana z wzajemnymi ruchami i oddziaływaniami na siebie poszczególnych jego części: cząsteczek, atomów i jonów.
Energia wewnętrzna składa się z energii kinetycznej ruchu postępowego i obrotowego cząsteczek i jonów, z energii potencjalnej wzajemnego oddziaływania cząsteczek na siebie oraz z energii kinetycznej i potencjalnej ruchu i oddziaływań jąder atomowych i elektronów w cząsteczkach i części składowych jądra atomowego - w jądrach.
Energia wewnętrzna jest jedną z podstawowych funkcji termodyn., określających stan układu
P - ciśnienie
v - objętość
Podstawową własnością tej funkcji jest to, że jej zmiana w procesie izobarycznym jest równa ciepłu wydzielanemu przez układ, jeżeli jedynym rodzajem pracy wykonanej przez układ jest praca zmiany objętości.
![]()
dS - przyrost entropii układu
dQ - ilość ciepła dostarczanego do układu
T - temp., w której układ pobrał ciepło
Jedną z podstawowych własności entropii jest to, że rośnie ona zawsze w procesach samorzutnych i nieodwracalnych, przebiegających w układach nie wymieniających z otoczeniem energii pod żadną postacią (w ukł. izolowanych).
(wyrażając temp. daną w stopniach Celcjusza w bezwzględnej skali temperatur stosuje się zależność T K = t C +273,10 s.t.)
Podaj sposób wyznaczania entelpii molowej czystych substancji.
Jeżeli poza pracą zmiany objętości żadna inna forma energii nie jest wymieniana z otoczeniem, to przy oziębianiu czy ogrzewaniu układu pod stałym ciśnieniem, ciepło pobrane lub wydzielone w czasie procesu odpowiada zmianie entalpii układu. W odniesieniu do reakcji chemicznych entalpia jest niczym innym, jak ciepłem reakcji pod stałym ciśnieniem.
Z uwagi na to, że wartość entalpii nie może być wyznaczana w postaci wartości bezwzględnej. Przyjęto w tym przypadku względny układ odniesienia. Założono mianowicie, że entalpia molowa substancji prostej, trwałej w temp. 25 C i pod ciśnieniem 1 atmosfery jest równa zeru. Wychodząc z tego założenia ułożono tablice standardowych molowych wartości entalpii tworzenia związków chemicznych.
Standardowa molowa entalpia tworzenia związków chemicznych jest to zmiana entalpii, która towarzyszy syntezie 1 mola zw. chem. pod ciśn. 1 atmosfery.
Korzystając z tablic możemy obliczyć entalpię, czyli ciepło dowolnej reakcji chemicznej pod stałym ciśnieniem w temp. 25 C
Zmiana entalpii reakcji (ciepło reakcji) jest to różnica pomiędzy sumą ciepła tworzenia produktów reakcji, a sumą ciepła tworzenia substratów reakcji.
ΔH = Σ ΔHo prod. - Σ ΔHo substr. gdzie ΔHo - standardowa entalpia tworzenia związ. chem.
Korzystając z tablic standardowych molowych wartości entalpii i pamiętając, że entalpia pierwiastków w stanie wolnym w warunkach standardowych jest równa zeru, można obliczyć ciepło dowolnej reakcji chemicznej, niezależnie od tego, czy daną reakcję można przeprowadzić w laboratorium, czy też jest to reakcja tylko hipotetyczna.
Oblicz entalpię syntezy ciekłego etanolu w temperaturze 298 K przebiegającej wedłóg reakcji:m: C2H(4) + H2O(2)= C2H5OH(4) , mając dane entalpie tworzenia związków w temperaturze 298 K:
C2H(4) ΔH0 - 92,37 kJ/mol
H2O(2) ΔH0 - 286,25 kJ/mol
C2H5OH(4) ΔH0 - 278,03 kJ/mol
Podaj prawo z jakiego korzystasz.
ΔH = Σ ΔHo prod. - Σ ΔHo substr. = -278,03 - [92,37 - 286,25] = -278,03 + 193,88 = ΔH = -84,15 [kJ/mol]
Co to jest czas półtrwania reakcji? Podaj wyrażenia na czasy półtrwania dla reakcji różnych rzędów.
Czas półtrwania reakcji to czas po którym stężenie jednego z reagentów zmniejszy się o połowę w stosunku do stężenia początkowego.
Rząd 0 |
Rząd 1 |
Rząd 2 |
Rząd 3 |
|
|
|
|
{Uwaga do tabelki- wszędzie gdzie jest c0 można podstawić a}
Omów wpływ katalizatorów na przebieg reakcji chemicznej. Podaj odpowiednie przykłady.
Katalizatory zmieniają szybkość reakcji. Zjawisko przez nie wywoływane nazywa się katalizą(reakcje katalizowane). Katalizatory zmieniają czas osiągnięcia stanu równowagi, lecz nie wpływają na stałą równowagi.
Równanie kinetyczne dla reakcji chemicznej n-tego rzędu z udziałem katalizatora: ![]()
Kataliza jednofazowa: ![]()
, ![]()
, ![]()
Działanie odwrotne do katalizatorów mają inhibitory- spowalniają reakcję. Dlatego cyjanek potasu jest zabójczy bo hamuje przemiany biologiczne.
Na przykładzie chlorku srebra i wodorotlenku miedzi zdefiniuj iloczyn rozpuszczalności. Jaka jest zależność pomiędzy iloczynem rozpuszczalności a rozpuszczalnością tych związków?
Rozpuszczalność elektrolitów zmienia się w małym stopniu, gdy do roztworów wodnych dodajemy substancje nie będące elektrolitami (np. cukier) lub elektrolity nie mające wspólnych (jednakowych) jonów w stosunku do elektrolitu zasadniczego, rozpuszczanego w wodzie. Natomiast dodanie do roztworu wodnego soli innego elektrolitu o wspólnym jonie powoduje spadek rozpusczalności soli. Na przykład, gdy do nienasyconego roztworu AgCl dodamy roztwór AgNO![]()
3 lub HCl, to możemy łatwo uzyskać stan nasycenia i doprowadzić do powstania osadu AgCl. Mówimy wówczas, że iloczyn rozpuszczalności AgCl został przekroczony. Możemy przyjąć, że dla nasyconego roztworu wodnego AgCl stężenie cząstek niezdysocjowanych [AgCl] ma wartość stałą (w stałej temperaturze). Wobec tego wyrażenie określające stan równowagi między cząsteczkami zdysocjowanymi i niezdysocjowanymi
![]()
Można zapisać w innej formie
![]()
Gdzie iloczyn dwóch wartości stałych K i [AgCl] jest również wartością stałą.
Iloczyn stężeń jonów trudno rozpuszczalnego elektrolitu w roztworze nasyconym nazywamy iloczynem rozpuszczalności.
Dla roztworu nasyconego wodnego AgCl w normalnych warunkach (20 C) stężenia jonów [Ag+] i [Cl-] są równe 1*10 ??? g jon/litr. Stąd iloczyn rozpuszcz. jest równy
![]()
Dodanie jakiegokolwiek rozpuszczalnego chlorku lub kwasu solnego do roztworu AgCl powoduje zwiększenie w roztworze stężenia jonów [Cl-]. Przekroczenie wartości iloczynu rozpuszczalności powoduje powstanie osadu AgCl.
Podobny skutek osiągamy przez dodanie rozpuszczonej soli ...............(np. Ag2NO3).
W przypadku ogólnym dla mocnego elektrolitu określonego wzorem chemicznym AxBy i trudno rozpuszczalnym w wodzie, wyrażenie na iloczyn rozpuszczalności ma postać:
L = [A]x [B]y
Przekroczenie wartości L przez dodanie innego elektrolitu o wspólnym jonie powoduje wytrącenie się osadu.
Co rozumiesz pod pojęciami ruchliwości i liczby przenoszenia jonów?
Ruchliwość jonów, czyli szybkość poruszania się jonów w polu elektr. zależy od:
rodzaju i stężenia jonów
lepkości ośrodka i temperatury
spadku napięcia
Rozróżniamy ruchliwość bezwzględną i względną. Stosuje się dwa rodzaje określenia szybkości jonów:
a. Bezwzględna szybkość wędrówki jonu (tzw. Ruchliwość jonu)
-szybkość w cm/s, jakiej nabiera jon w polu elektrycznym o spadku potencjału 1V/cm
Natężenie pola elektr. w elektrolicie wynosi E=V/1 woltów/cm
Szybkość wędrówki jonów V = uE
napiecie: V woltów
odl. między elektrodami: 1 cm
Współczynnik proporcjonalności u jest bezwzględną szybkością wędrówki jonu.
Ruchliwość jonów zależy od rodzaju jonu, rozpuszczalnika, temperatury i stężenia
(W rozcieńczeniu nieskończenie wielkim ruchliwość jonów osiąga wartość max. Dla danej temp. i rozpuszczalnika i nazywana jest ruchliwością graniczną)
b. Ruchliwość względna (liczba przenoszenia jonów = liczba Hottorfa)
liczbę przenoszenia kationu nk i anionu na oblicza się wg wzorów
![]()
![]()
u+, u- : bezwzględna szybkośćwędrówki kationu i anionu; nk, na: liczby przenoszenia kationu i anionu
Suma przenoszenia kationów i anionów nk+na=1
Liczby przenoszenia wskazują, jaka część ogólnej liczby elektryczności, która przepłynęła przez obwód podczas elektrolizy, została przeniesiona przez kationy, a jaka przez aniony.
[Iloczyn ruchliwości jonu i stałej Faradaya nazywa się przewodnictwem jonowym]
Na przykładach omów półogniwa II rodzaju (schemat, reakcje, potencjał).
Na przykładach omów półogniwa II-go rodzaju (schemat, relacje, potencjał)
Półogniwa II-go rodzaju - półogniwa odwracalne względem anionu - metale pokryte solą trudno rozp. tego metalu i zanurzone do roztworu elektrolitów o anionie identycznym z anionem soli trudno rozpuszcz. Na granicy faz ustala się równowaga j.w. Ogniwa drugiego rodzaju zawierają dwie granice faz: 1. roztwór - sól trudno rozpuscz., 2. sól trudno rozpuszcz. - metal
Typowym przykładem jest elektroda kalomelowa (?) składająca się z naczynka, w którym umieszczony jest w charakterze kontaktu drucik platynowy (pt) zanurzony w warstwie rtęcie znajdującej się na dnie naczynka. Rtęć pokryta jest warstwą mieszani rtęci iż kalomelem Hg2Cl2, ponad którą znajduje się roztwór KCl. W roztworze KCl.......................................................z iloczynem rozpuszczalności Hg2Cl2
Jakie procesy zachodzą podczas elektrolizy wodnego roztworu ługu?
Podczas elektrolizy zasad przy anodzie wydziela się tlen. Reakcja anodowa ma na ogół postać:
4OH- O2 + 2H2O + 4e-
Jony wodorotlenkowe ulegają przy anodzie utlenieniu i wydziela się gazowy tlen. Np. elektroliza wodnego NaOH prowadzi do wydzielenia się wodoru i tlenu.
Dokończ reakcje i nazwij wszystkie występujące w niej związki:
Reakcje może zmienić więc nic nie dopisuję…
Wytłumacz na przykładach mechanizm addycji elektrofilowej.
Addycja elektrofilowa AE
Sposoby otrzymywania i właściwości chemiczne aldehydów i ketonów.
Aldehydy i ketony to pochodne węglowodorów. Zawierają charakterystyczną grupę karbonylową C=O
Gdy jedna z dwóch wartościowości atomu węgla grupy karbonylowej związana jest z rodnikiem organicznym, a druga z atomem wodoru to powstaje nam wzór ogólny aldehydu. W przypadku gdy obydwie wartościowości węgla związane są z rodnikami organicznymi, to otrzymujemy wzór ogólny ketonu.
O R
R-C ALDEHYD KETON C=O
H R
Podstawnikiem w grupie karbonylowej może być zarówno rodnik alkilowy jak i arylowy. Z tego względu wyróżniamy aldehydy i ketony alifatyczne oraz aromatyczne.
Otrzymywanie:
Łagodne utlenianie alkoholi pierwszorzędowych:
R-CH2OH RCHO R-COOH
(Ketony) utlenianie alkoholi drugorzędowych
Odwodorowanie alkoholi drugorzędowych
Hydroliza ozonków
Przyłączanie wody do alkinów - reakcja Kuczerewa
Rozpad ketonowy β-ketonoestrów
Właściwości:
Temperatura wrzenia aldehydów i ketonów o podobnej masie cząsteczkowej są zbliżone do siebie.
Aldehydy o większej masie cząsteczkowej mają dość przyjemny zapach
Ketony z reguły mają przyjemny zapach
Niektóre ketony o małych masach cząsteczkowych są dobrymi rozpuszczalnikami
Aldehydy i ketony mają charakter redukujący - z tym, że aldehydy wykazują znacznie silniejsze właściwości redukujące
Stosuje się je przy produkcji luster (tzw. reakcja lustra srebrnego)
Co to są roztwory buforowe i jak się oblicza pH buforu?
Są to roztwory, których wartość pH po dodaniu mocnych kwasów albo zasad, jak i po rozcieńczeniu wodą zmienia się nieznacznie. Roztworami buforowymi są najczęściej wodne roztwory słabych kwasów albo zasad i ich odpowiednich soli o zbliżonych stężeniach. Rolę mieszanin buforowych spełniają również roztwory wodorosoli np. NaHCO3, NaH2PO4 lub Na2HPO4.
Według teorii Bronsteda i Lowry'egobuforami są zatem roztwory słabych kwasów i sprzężonych z nimi zasad (np. CH3COOH i CH3COO-, HCOOH i HCOO-, HCO3- i CO22-, H2PO4- i HPO42- lub HPO42- i PO43-) albo roztwory słabych zasad i sprzężonych z nimi kwasów (np. NH3 i NH4+).
pH = pKHA - lg(Ckw / Csoli)
pH = pKw - pKBOH + lg(Czasady / Csoli)
Podaj metody otrzymywania i koagulacji koloidów.
Otrzymywanie poprzez zmieszanie dwóch składników?- nie mam pojęcia o co jej chodzi w tym pytaniu.
Koagulacja- przechodzenie zolu w żel. Rozróżnia się odwracalną- gdy można ją odwrócić prostymi środkami, nieodwracalna gdy przejście żelu w zol nie jest możliwe. Zjawisko odwrotne do koagulacji to peptyzacja. Koagulację koloidów może wywołać- dodanie elektrolitów, dodanie koloidu o przeciwnym ładunku, dodanie nieelektrolitów o dużym stężeniu, działanie temperatury, działanie światła, dehydratyzacja lub desolwatacja.
To też możę być:
Gaz |
gaz |
|
nie istnieją |
|
ciecz |
mgła |
mgła, chmury |
|
ciało stale |
gazozole, aerozole stałe |
dym, kurz |
Ciecz |
gaz |
piany, zole |
piana mydlana |
|
ciecz |
emulsje |
mleko, roztwór żelatyny |
|
ciało stale |
zole, suspensoidy |
roztwory koloidalne w wodzi siarczków ,tlenków i wodorotlenków metali |
Ciało stałe |
gaz |
piany stałe |
pumeks, sepiolit |
|
ciecz |
piany, emulsje stałe |
opale, kwarc mleczny |
|
ciało stale |
zole stałe |
szkło rubinowe, perły fosforowe |
Zdefiniuj pojęcia napięcia powierzchniowego i lepkości.
Lepkość - zdolność płynu do przekazywania pędu pomiędzy warstwami poruszającymi się z różnymi prędkościami.
Lepkość dynamiczna
Jednostką lepkości dynamicznej w układzie SI jest: kilogram•metr-1•sekunda-2
Lepkość kinematyczna jest stosunkiem lepkości dynamicznej do gęstości płynu:
Jednostką lepkości kinematycznej w układzie SI jest: metr2•sekunda-1 Jej nazwa pochodzi od tego, że jest wyrażona jedynie przez wielkości właściwe kinematyce.
Napięcie powierzchniowe to zjawisko fizyczne występujące na styku powierzchni cieczy z ciałem stałym, gazowym, lub inną cieczą. Polega na powstawaniu dodatkowych sił działających na powierzchnię cieczy w sposób kurczący ją (przyciągający do wnętrza cieczy). Zjawisko to ma swoje źródło w siłach przyciągania pomiędzy molekułami cieczy. Występuje ono także zawsze na granicy faz termodynamicznych.
Efektem napięcia powierzchniowego jest np. utrudnione zanurzanie w cieczy ciał nie podatnych na zwilżanie tą cieczą (znika ono w momencie całkowitego zanurzenia takiego ciała). Innym zjawiskiem związanym z napięciem powierzchniowym jest podnoszenie się cieczy w wąskich rurkach.
Substancjami przeciwdziałającymi napięciu powierzchniowemu są m.in. emulgatory oraz mydła i detergenty.
1
Otoczenie
-484 kJ
Układ
2H2(g)+O2(g)→2H2O(g) +484 kJ
ΔH=q pod stałym ciśnieniem
Wyszukiwarka
Podobne podstrony:
sem2-egzamin-materialy3, SEM 2, chemia
sem2-egzamin-pytania, SEM 2, chemia
CHEMIA-ŻYWNOŚCI-sem.-IV, STUDIA PŁ, TECHNOLOGIA ŻYWNOŚCI I ŻYWIENIA CZŁOWIEKA, ROK II, SEM 4, Chemia
Egzamin(zad.) sem.3, Technologia chemiczna, Chemia fizyczna, Egzamin
Egzamin(pyt.) sem.3, technologia chemiczna, chemia fizyczna
Pytania abcd z zeszłorocznego egzaminu z chemii, Szkoła Rolnictwo studia, Szkoła, Materiały studia,
materiałoznawstwo - 3 zestawy, Inżynieria Środowiska [PW], sem 2, Materiałoznawstwo, egzamin materia
Przykładowy egzamin po I sem, MATERIAŁY NA STUDIA, INŻYNIERIA PROCESOWA, LABOLATORIUM INŻYNIERIA PRO
wytrzymalosc mat egzamin, Studia, Sem III OiO, Wytrzymałość materiałów
Pytania-egzamin, Inżynieria Środowiska [PW], sem 1, chemia
PoprawioneMateriały, Inżynieria Środowiska [PW], sem 2, Materiałoznawstwo, egzamin materiałka
egzamin z chemii, Szkoła Rolnictwo studia, Szkoła, Materiały studia, chemia org
więcej podobnych podstron