1. Część teoretyczna.
Ćwiczenie polega na zmierzeniu zmian oporności elektrolitu w funkcji stężenia, przeliczeniu uzyskanych danych na wartości przewodnictwa właściwego oraz równoważnikowego, ekstrapolowaniu funkcji ![]()
do ![]()
i wyznaczeniu w ten sposób granicznego przewodnictwa równoważnikowego ![]()
. Pomiar przewodnictwa elektrolitu wykonuje się za pomocą mostka Wheatstone'a, w którym badana oporność jest równoważona w stosunku do oporności wzorcowej.
Oporność elektryczna:
![]()
,
gdzie: r - oporność właściwa
![]()
- przewodnictwo właściwe
Przewodnictwo właściwe roztworu elektrolitycznego:
![]()
,
gdzie: k - stała naczynka konduktometrycznego
Przewodnictwo równoważnikowe:
![]()
,
gdzie: V - objętość roztworu w ![]()
w której zawarty jest 1 mol równoważników substancji rozpuszczonej,
c - stężenie wyrażone w mol równoważników na 1 dm3
Dla mocnych elektrolitów przy dużych rozcieńczeniach ![]()
, a jeszcze bardziej ![]()
, jest zbliżona do prostej i może być ekstrapolowana do wartości granicznej
(dla ![]()
) zwanym granicznym przewodnictwem równoważnikowym. Dla słabych elektrolitów od obliczenia granicznej przewodności równoważnikowej używa się wzoru ![]()
, wykres ![]()
dla takich elektrolitów nie jest linią prostą.
Prawo Kohlrauscha - w roztworze nieskończenie rozcieńczonym przewodnictwo elektrolitu np. NaCl jest sumą niezależnych udziałów odpowiadających jonom Na+ i Cl-. Prawo to uniemożliwia określenie udziałów poszczególnych jonów.
2. Część doświadczalna
Aparatura i odczynniki:
konduktometr,
Termostat,
Naczyńko do pomiaru przewodności,
Kolby miarowe,
Pipety
Roztwory wodne: KCl, NaCl, HCl, Ch3COOH,
Przebieg doświadczenia:
W celu wyznaczenia stałej oporowej „k” naczyńka pomiarowego przygotowano roztwór KCl o dwóch różnych stężeniach 0,1 M i 0,01 M i mierzono przewodnictwo, wykonując po trzy pomiary dla każdego stężenia.
Następnie mierzono przewodnictwo następujących elektrolitów: NaCl, HCl, CH3COOH o przygotowanych wcześniej dla każdego z nich różnych stężeniach: 0,1M, 0,05M, 0,025M, 0,0125M, 0,00625M. Dla każdego stężenia wykonano trzy pomiary kondunktancji.
Tabela wyników pomiarowych nr 1
Stężenie roztworu wzorcowego KCl {M} |
Przewodnictwo roztworu wzorcowego |
||
|
|
|
|
0,1 |
24800 |
24800 |
24900 |
0,01 |
2910 |
2940 |
2940 |
Tabela wyników pomiarowych nr 2
Stężenie roztworu NaCl {M} |
Przewodnictwo roztworu |
||
|
|
|
|
0,1 |
20300 |
20400 |
20500 |
0,01 |
10940 |
11010 |
11080 |
0,025 |
5860 |
5900 |
5910 |
0,013 |
3050 |
3060 |
3060 |
0,0063 |
1541 |
1542 |
1542 |
Tabela wyników pomiarowych nr 3
Stężenie roztworu HCl {M} |
Przewodnictwo roztworu |
||
|
|
|
|
0,1 |
74300 |
75200 |
75800 |
0,01 |
39200 |
39900 |
39900 |
0,025 |
20700 |
20700 |
20700 |
0,013 |
10670 |
10680 |
10680 |
0,0063 |
5460 |
5470 |
5490 |
Tabela wyników pomiarowych nr 4
Stężenie roztworu CH3COOH {M} |
Przewodnictwo roztworu |
||
|
|
|
|
0,1 |
485 |
486 |
486 |
0,01 |
342 |
346 |
346 |
0,025 |
244 |
245 |
245 |
0,013 |
173,1 |
173,2 |
173,3 |
0,0063 |
122,4 |
122,5 |
122,6 |
0,0031 |
86 |
85,9 |
85,8 |
0,0016 |
60,5 |
60,7 |
60,9 |
3. Opracowanie i dyskusja wyników.
Sporządzono wykresy
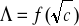
dla badanych elektrolitów: NaCl - wykres nr 1, HCl - wykres nr 2, CH3COOH - wykres nr 3. Wykresy dla mocnych elektrolitów NaCl i HCl dają się aproksymować do linii prostej, natomiast dla elektrolitu słabego jest to nie możliwe. Przewodnictwo roztworu słabego elektrolitu asymptotycznie dąży do przewodnictwa granicznego, odpowiadającego dużemu rozcieńczeniu.Wyznaczono graficznie
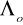
oraz współczynnik kierunkowy prostej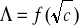
![]()
![]()
![]()
![]()
Wartości tablicowe ![]()
:
![]()
![]()
Wartości obliczone na podstawie granicznych przewodnictw jonowych:
![]()
![]()
![]()
![]()
![]()
![]()
Porównanie wyników:
Wartości ![]()
dla roztworów HCl i NaCl wyznaczone graficznie niewiele różnią się od wartości tablicowych, natomiast te wyznaczone na podstawie granicznych przewodnictw jonowych, przy wykorzystaniu poprawek temperaturowych, znacząco różnią się od pozostałych wyników. Można z tego wnioskować, iż prawdopodobnie pomiar temperatury w miejscu wykonywania doświadczenia mógł zostać źle wykonany.
Wartość współczynnika kierunkowego obliczono z uproszczonego wzoru Debye'a-Hücklea-Onsagera:
![]()
![]()
a=-88,28
![]()
a=-154,93
Współczynniki kierunkowe prostych ![]()
dla roztworu NaCl i HCl różnią się od tych obliczonych z równania Debye'a-Hücklea-Onsagera odpowiednio o 2,35 i 37,1 %
Wyznaczono
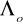
kwasu octowego korzystając z równania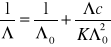
i wykresu nr 4 -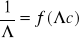
Λo= 303,03 [cm2/(mol⋅Ω)]
Podobnie z wykresu nr 5 ![]()
korzystając z równania ![]()
wyznaczono:
Λo= 303,03 [cm2/(mol⋅Ω)]
Na podstawie prawa Kohlrauscha dla danej temperatury (22,5 0C) obliczono wartość
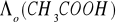
z wykorzystaniem:
- tablicowych wartości odpowiednich przewodnictw jonowych.
![]()
![]()
![]()
[cm2/mol⋅Ω]
![]()
![]()
[cm2/mol⋅Ω]
![]()
[cm2/(mol⋅Ω)]
- tablicowej wartości ![]()
(CK3COONa) oraz ![]()
NaCl i HCl wyznaczone w ćwiczeniu.
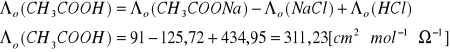
Obliczono dla elektrolitu mocnego i słabego stopnie dysocjacji
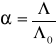
.Obliczono stałą równowagi reakcji jonizacji słabego elektrolitu z prawo rozcieńczeń Ostwalda:
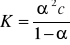
.
Stężenie C [M] |
Stopień dysocjacji |
||
|
NaCl |
HCl |
Kw. Octowy |
0,1000 |
0,773 |
0,822 |
- |
0,0500 |
0,834 |
0,874 |
- |
0,0250 |
0,892 |
0,907 |
0,0154 |
0,0125 |
0,927 |
0,935 |
0,0218 |
0,0063 |
0,935 |
0,959 |
0,0306 |
0,0031 |
- |
- |
0,0432 |
0,0015 |
- |
- |
0,0587 |
Analizując dane zawarte w tabeli nr 1 (wyznaczanie stopni jonizacji badanych elektrolitów) wzrost stopnia jonizacji dla obydwóch elektrolitów wzrasta wraz wzrostem rozcieńczenia roztworu elektrolitu (gdy![]()
, ![]()
), przyczyną tego jest wzrost ruchliwości jonowej. Porównując stopie jonizacji dla NaCl (HCl) i CH3COOH łatwo zauważyć, że wartości![]()
przy tych samych stężeniach są znacznie większe dla NaCl (HCl) (łatwiej ulega dysocjacji). Analiza stopnia jonizacji potwierdza iż mocnym elektrolitem jest NaCl i HCl, natomiast CH3COOH stanowi słaby elektrolit.
Stężenie C [M] |
α |
K [M] |
K średnia [M] |
0,0250 |
0,0154 |
|
0,611⋅10-5 |
0,0125 |
0,0218 |
|
|
0,0063 |
0,0306 |
|
|
0,0031 |
0,0432 |
|
|
0,0016 |
0,0587 |
|
|
Obliczona średnia stała równowagi jonizacji dla kw. octowego wynosi Kśr=2,685⋅10-5 M, natomiast literaturowa wartość wynosi dla temp.25,10C K= 1,754⋅10-5 M błąd względny 53,07%. Przyczyną otrzymania takiego błędu może być spowodowane:
- błąd popełniony przy rozcieńczeniu roztworu wyjściowego (0,1M) w celu otrzymania określonych stężeń.
- otrzymane przewodnictwo graniczne jest większe od literaturowego,
- błędy w wyznaczeniu przewodnictwa granicznego,
- błędy w odczycie wskazań potencjometru (skoki wartości kondunktancji),
1
Wyszukiwarka
Podobne podstrony:
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
Wyznaczanie 10.6L, semestr 4, chemia fizyczna, sprawka laborki, 10.6
10.6 poprawione, semestr 4, chemia fizyczna, sprawka laborki, 10.6
spr 8.5 obliczenia1, semestr 4, chemia fizyczna, sprawka laborki, 8.5
6, semestr 4, chemia fizyczna, sprawka laborki, 6.11
1.11badanie aktywacji reakcji 6, semestr 4, chemia fizyczna, sprawka laborki, 6.11
Ćwiczenie 6.11, semestr 4, chemia fizyczna, sprawka laborki, 6.11
8.5 wykres, semestr 4, chemia fizyczna, sprawka laborki, 8.5
spr 8.5 obliczenia1, semestr 4, chemia fizyczna, sprawka laborki, 8.5
28fizyczna, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyc
sekuła, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizyczna,
zawiejski, inżynieria materiałowa - semestr 4, Inżynieria Materiałowa pwr - semestr 4, Chemia Fizycz
więcej podobnych podstron