Aminokwasy
Repetytorium
Podział aminokwasów.
Właściwości aminokwasów-aminokwasy jako jony obojnacze.
Leki o budowie aminokwasowej.
Choroby związane z zaburzeniami przemiany materii aminokwasów.
Chromatografia bibułowa.
Część praktyczna
Reakcje charakterystyczne dla aminokwasów.
Identyfikacja dwóch aminokwasów.
Chromatografia bibułowa aminokwasów.
Repetytorium
Aminokwasami nazywamy związki zawierające w swej cząsteczce dwie charakterystyczne grupy funkcyjne: aminową - NH2 i karboksylową - COOH.
Aminokwasy są najmniejszymi elementami strukturalnymi białek, polipeptydów i peptydów we wszystkich organizmach żywych, od bakterii do człowieka tak więc
najważniejszą reakcją aminokwasów, z punktu widzenia biochemicznego, jest reakcja tworzenia wiązania peptydowego (amidowego). Reakcja ta nie przebiega jednak łatwo, gdyż stała równowagi przesunięta jest w kierunku hydrolizy wiązania peptydowego. Aby przeprowadzić syntezę wiązania peptydowego, jedna z grup karboksylowych musi być zaktywowana. Jednym ze sposobów laboratoryjnych jest przeprowadzenie grupy karboksylowej w chlorek kwasowy i kondensacja otrzymanego chlorku z grupą aminową drugiego aminokwasu. W przyrodzie aktywacja grupy karboksylowej zachodzi w wyniku kondensacji z ATP (powstaje aminoacyloadeninan) i następnie zachodzi kondensacja z grupą aminową drugiego aminokwasu.
Powstające wiązanie peptydowe jest planarne (płaskie). Dzięki stabilizacji rezonansowej ma częściowo charakter wiązania podwójnego, zatem zahamowana jest swobodna rotacja wokół wiązania C-N i występuje izomeria cis-trans. Trans- konfiguracja jest korzystniejsza energetycznie niż cis-konfiguracja i częściej występuje w łańcuchach peptydowych.
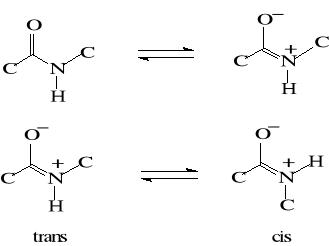
Usztywnienie wiązania peptydowego wpływa na kształtowanie struktury białek.
Aminokwasy występujące w białkach są kwasami aminokarboksylowymi o konfiguracji L. Wszystkie z wyjątkiem glicyny są czynne optycznie. Oprócz aminokwasów budujących białka istnieje oczywiście cała gama aminokwasów niebiałkowych, które odgrywają ważną rolę w wielu procesach biochemicznych zachodzących w żywych organizmach. Mogą być substratami w utlenianiu komórkowym, w syntezie różnorodnych związków biologicznie czynnych. Aminokwasy lub ich pochodne są neuroprzekaźnikami, neurohormonami lub klasycznymi hormonami.
Aminokwasy zatem spełniają następujące funkcje:
1) tworzenie białek- rola strukturalna, hormonalna i katalityczna,
2) uczestnictwo w różnorodnych funkcjach wewnątrzkomórkowych jak: przenoszenie
impulsów w układzie nerwowym, regulacja wzrostu komórkowego, biosynteza
porfiryn, puryn, pirymidyn i mocznika,
3) biosynteza antybiotyków polipeptydowych i substancji przeciwnowotworowych.
Istnieje 20 podstawowych aminokwasów budujących białka. Wszystkie one posiadają własne kodony genetyczne warunkujące wbudowanie ich w łańcuch polipeptydowy. Olbrzymia różnorodność kombinacji połączeń aminokwasów warunkuje istnienie wielu białek, które to determinują olbrzymią ilość gatunków. Niewielka zmiana w kolejności połączenia aminokwasów powoduje zmiany w funkcji białka, stąd też olbrzymie zainteresowanie budową białek i możliwościami badania ich struktury. Aby określić kolejność aminokwasów stosuje się metody chemiczne:
Określenie rodzaju aminokwasów i ich ilości - hydroliza białka (kwasowa, zasadowa lub najczęściej enzymatyczna)
Częściowa hydroliza białka na peptydy i następnie:
a) oznaczanie N-końcowego aminokwasu,
b) oznaczanie C-końcowego aminokwasu.
3. Oznaczenie sekwencji aminokwasów
Podział aminokwasów
Ze względu na budowę łańcucha R aminokwasy zostały podzielone na siedem grup:
1. Aminokwasy alifatyczne obojętne: glicyna (Gly), alanina (Ala), walina (Val),
leucyna (Leu), izoleucyna (Ile)
2. Aminokwasy alifatyczne- hydroksyaminokwasy: seryna (Ser), treonina (Thr)
3. Aminokwasy zawierające siarkę: cysteina (Cys), cystyna (Cys-Cys),
metionina (Met)
4. Iminokwasy : prolina (Pro), hydroksyprolina (Hyp)
5. Aminokwasy zasadowe: lizyna (Lys), hydroksylizyna (Hyl), arginina (Arg),
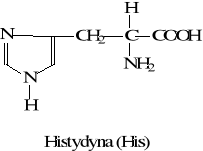
histydyna (His)
6. Aminokwasy kwaśne i ich monoamidy: kwas asparaginowy (Asp), asparagina
(Asn), kwas glutaminowy (Glu), glutamina (Gln)
7. Aminokwasy aromatyczne i heteroaromatyczne: fenyloalanina (Phe),
tyrozyna (Tyr), tryptofan (Trp)
Natura łańcuchów bocznych jest odpowiedzialna za właściwości fizykochemiczne aminokwasów stąd też dzielimy aminokwasy na
aminokwasy hydrofobowe
aminokwasy polarne
a). obdarzone ładunkiem
b). pozbawione ładunku
Ze względu na zapotrzebowanie aminokwasów przez organizm zwierzęcy aminokwasy można podzielić na :
Aminokwasy egzogenne - niezbędne do prawidłowego funkcjonowania organizmu zwierzęcego, ale nie wytwarzane przez ten organizm. Muszą być dostarczane z zewnątrz wraz z pokarmem.
Dla organizmu człowieka są to: walina, leucyna, izoleucyna, lizyna, fenyloalanina, metionina, treonina, tryptofan, arginina, histydyna (niezbędna dla dzieci do 12 lat).
Aminokwasy endogenne - niezbędne do prawidłowego funkcjonowania organizmu i wytwarzane przez ten organizm.
Dla organizmu człowieka są to: glicyna, alanina, seryna, cysteina, tyrozyna, kwas asparaginowy, kwas glutaminowy, hydroksyprolina, asparagina, glutamina, prolina.
Bardzo ważny dla prawidłowego funkcjonowania organizmu jest odpowiedni dobór diety bogatej w aminokwasy egzogenne, jeśli zabraknie choć jednego aminokwasu egzogennego pozostałe aminokwasy, choć dostarczane w odpowiedniej ilości, nie są całkowicie wykorzystywane przez organizm. Mówiąc o odpowiedniej diecie mamy oczywiście na myśli dobór odpowiedniej diety białkowej, gdyż to białka są dla organizmu głównym źródłem aminokwasów.
Nadmierne zaś ilości białek, a zatem i aminokwasów, w odróżnieniu od lipidów i cukrów, nie są magazynowane. Aminokwasy, które nie zostały bezpośrednio wbudowane w białko ulegają dezaminacji. Azot zostaje usunięty z organizmu w postaci mocznika, a łańcuchy węglowe są wykorzystywane do biosyntezy tłuszczów i węglowodanów.
2. Właściwości aminokwasów-jako jony obojnacze
Cząsteczka aminokwasu w roztworze wodnym występować może w jednej z trzech postaci:
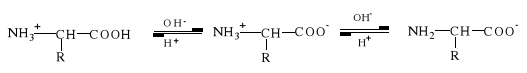
1 2 3
Przewaga odpowiedniej postaci aminokwasu zależy od pH roztworu.
Wartość pH, przy której cząsteczka aminokwasu występuje głównie jako jon obojnaczy, nazywamy punktem izoelektrycznym (pI). Gdy pH>pI - aminokwas występuje w postaci anionu, gdy pH<pI - aminokwas jest w postaci kationu.
Wzory aminokwasów białkowych
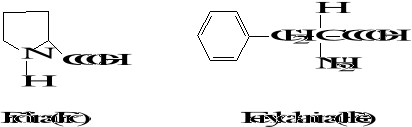
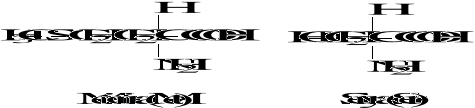
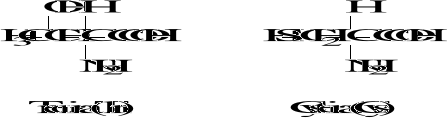
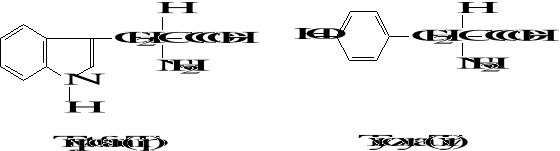
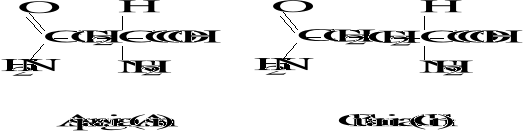
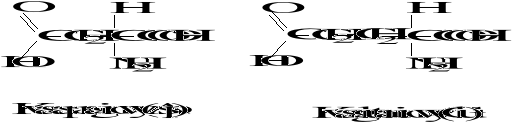
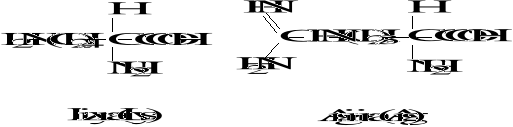
3. Biologicznie ważne peptydy
Aminokwasy tworzą wiele oligopeptydów i polipeptydów odgrywających ważne funkcje w żywych organizmach np.: glutation (γ-glutamylocysteinyloglicyna, tripeptyd H-γ-Glu-Cys-Gly-OH, odgrywa zasadniczą rolę w procesach utleniania i redukcji dzięki obecności grup -SH), angiotensyna II (hormon tkankowy o budowie oktapeptydu H-Asp-Arg-Val-Tyr-Ile-His-Pro-Phe-OH, zwęża naczynie krwionośne i jest najsilniejszym czynnikiem podwyższającym ciśnienie krwi, nasila uwalnianie noradrenaliny), bradykinina (hormon tkankowy o budowie nonapeptydu H-Arg-Pro-Pro-Gly-Phe-Ser-Pro-Phe-Arg-OH, obniża ciśnienie krwi-zatem działa antagonistycznie do angiotensyny, odpowiedzialna jest również za uczucie bólu, który towarzyszy uszkodzeniu (zranieniu) skóry), oksytocyna (nonapeptyd, hormon tylnego płata przysadki, działa na system mięśni gładkich, zwłaszcza macicy ciężarnej, wywołuje wydzielanie mleka z gruczołów sutkowych w okresie karmienia), wazopresyna (hormon tylnego płata przysadki, nonapeptyd (hormon antydiuretyczny, ADH) zwiększa wchłanianie zwrotne w dystalnych kanalikach nerkowych. Niedobór ADH powoduje moczówkę prostą), gramicydyna S (antybiotyk działający na bakterie Gram-dodatnie, stosowany w leczeniu oparzeń, owrzodzeń, zakażonych ran), substancja P (neurohormon zbudowany z 11 reszt aminokwasowych, bierze udział w przewodzeniu bodźców bólowych), glukagon (hormon zbudowany z 29 reszt aminokwasowych, jest antagonistą insuliny, zwiększa stężenie glukozy we krwi), endorfiny i enkefaliny (grupa oligo- i polipeptydow wyodrębnionych z przysadki mózgowej), insulina (hormon wytwarzany przez komórki β-trzustki, zmniejsza stężenie glukozy we krwi, stosowana w leczeniu cukrzycy) itd.
4. Leki o budowie aminokwasowej
Antybiotyki peptydowe są głównie produktami metabolizmu mikroorganizmów. Często są one odporne na działanie enzymów proteolitycznych, znajdujących się w normalnych komórkach. Przyczyną tego jest nie tylko cykliczna budowa tych antybiotyków, ale także występujące w ich łańcuchach peptydowych, mało spotykane w białkach, elementy strukturalne, takie jak D-aminokwasy, rzadkie aminokwasy i nie peptydowe wiązania między resztami.
Do grupy leków aminokwasowych zaliczyć można penicyliny. Cząsteczka penicyliny jest produktem cyklizacji dwóch aminokwasów: L-cysteiny i D-waliny. Poszczególne penicyliny różnią się od siebie tylko resztą R, którą w przypadku najbardziej znanego antybiotyku z tej grupy jest reszta benzylowa.
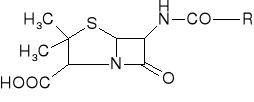
penicylina
Choroby związane z zaburzeniami przemiany aminokwasów
Przyczynami tych chorób są:
niedobór odpowiednich enzymów
pierwotne zaburzenia wchłaniania zwrotnego w cewkach nerkowych.
Wspólnym objawem jest obecność aminokwasów w moczu - czyli aminoacyduria. Zaburzenia przemiany aminokwasowej z powodu braku odpowiednich enzymów powodują nagromadzenie się w organizmie toksycznych związków co wtórnie powoduje uszkodzenie tkanek i układów (nerwowego, wydzielniczego).
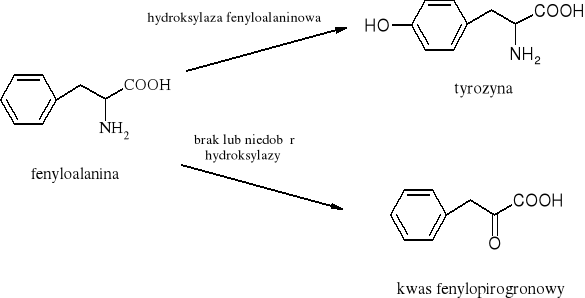
Jedną z chorób, znaną od 1953 roku jest fenyloketonuria - choroba uwarunkowana genetycznie. Przyczyną jej występowania jest brak lub mała aktywność enzymu-hydroksylazy fenyloalaninowej (enzym ten przekształca fenyloalaninę w tyrozynę). W konsekwencji fenyloalanina przekształca się nie w tyrozynę, a w kwas fenylopirogronowy, którego nadmiar prowadzi do uszkodzenia centralnego układu nerwowego i niedorozwoju u noworodka. Testy przeprowadzane na krwi noworodków dają możliwość wczesnego wykrycia choroby. Leczenie oparte jest o niskofenyloalaninową dietę do szóstego roku życia dziecka, potem CUN staje się odporny na wysokie stężenie fenyloalaniny i może nastąpić powrót do normalnej diety.
6. Chromatografia bibułowa
Chromatografia bibułowa jest odmianą chromatografii podziałowej, w której rolę nośnika odgrywa odpowiednio spreparowana bibuła filtracyjna. Najczęściej używane bibuły pochodzą z firmy Whatmana i w zależności od stosowanej techniki są odpowiednio zróżnicowane (Whatman 1, 2, 3, 3MM).
Chromatografię bibułową można wykonać techniką zstępującą (spływową), wstępującą i krążkową.
W chromatografii zstępującej migracja składników odbywa się z góry w dół, w chromatografii wstępującej wykorzystana jest kapilarna struktura bibuły umożliwiająca migrację solwentu do góry. W chromatografii krążkowej natomiast ruch rozpuszczalnika odbywa się odśrodkowo na krążku bibuły umieszczonym między dwiema płytkami Petriego. Ten sposób rozdziału wymaga niewiele bibuły, pozwala na stosunkowo szybkie uzyskanie rozdziału mieszaniny i umożliwia wywołanie chromatogramu, pociętego na fragmenty, jednocześnie kilkoma próbami identyfikacyjnymi. Ponadto na jednym krążku można wyznaczyć sektory i wykonać jednocześnie rozdziału mieszaniny oraz odpowiednich substancji wzorcowych. Identyfikację poszczególnych składników mieszaniny wykonuje się porównując położenia ich plam i plam odpowiednich substancji wzorcowych oraz obliczając współczynnik Rf
Część praktyczna
Reakcje charakterystyczne dla aminokwasów
Identyfikacja dwóch aminokwasów
Chromatografia bibułowa aminokwasów
Reakcje charakterystyczne dla aminokwasów
1. Wykrywanie grupy aminowej
Reakcji dezaminacji ulegają wszystkie aminokwasy występujące w strukturze białek zawierające pierwszorzędową grupę aminową -NH2

Do 2 cm3 wodnego roztworu dowolnego aminokwasu dodać kilka kryształków KNO2 i parę kropli 5% roztworu kwasu siarkowego. Wydzielają się pęcherzyki azotu.
2. Reakcja z ninhydryną
Aminokwasy zawierające w cząsteczce ugrupowanie -NH2 tworzą z ninhydryną związek o charakterystycznym niebiesko-fioletowym zabarwieniu. W trakcie tej reakcji aminokwas ulega dekarboksylacji, dezaminacji i utlenieniu. Reakcję tą pozytywnie dają także inne związki zawierające pierwszorzędową grupę aminową czyli np.: aminy, aminocukry, białka, peptydy i amoniak.
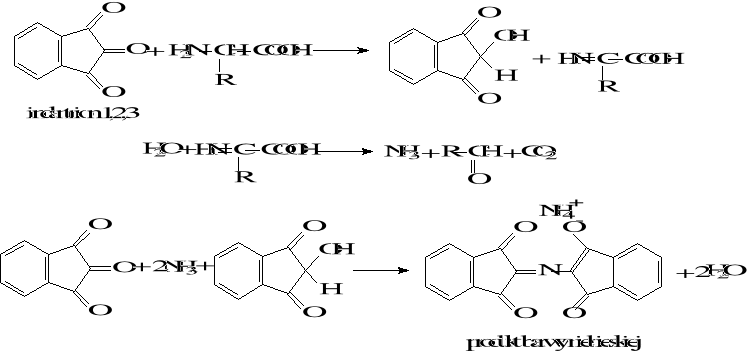
Dla proliny i hydroksyproliny reakcja ma nieco inny przebieg. Powstają w jej wyniku: związek o zabarwieniu żółtym dla proliny, różowym dla hydroksyproliny:
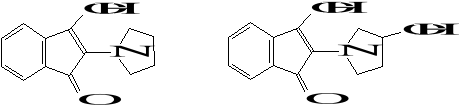
Powstające barwne związki są dobrze rozpuszczalne w wodzie, a intensywność zabarwienia jest zależna od stężenia aminokwasu w analizowanym roztworze. Reakcja nadaje się więc do oznaczania ilościowego aminokwasów metodą kolorymetryczną.
Do 1 cm3 roztworu aminokwasu dodać dwie krople 1% roztworu alkoholowego ninhydryny. Po ogrzaniu występuje charakterystyczne zabarwienie: dla większości aminokwasów fioletowo-niebieskie, dla proliny żółte, dla hydroksyproliny różowe.
3. Reakcja z aldehydem mrówkowym
Aminokwasy tworzą z formaldehydem słabą zasadę Schiffa uwalniając jednocześnie proton. Powoduje to zakwaszenie środowiska.

Do probówki dodać 2 cm3 aminokwasu oraz jedną kroplę alkoholowego roztworu fenoloftaleiny. Roztwór zalkalizować 0,1 M NaOH do lekko różowej barwy. Następnie do probówki dodać około 1 cm3 roztworu 3% formaliny zalkalizowanej 1% NaOH wobec fenoloftaleiny do lekko różowej barwy. Po wymieszaniu zawartości probówki różowe zabarwienie roztworu znika.
4. Reakcja ksantoproteinowa
Aminokwasy zawierające w cząsteczce pierścień aromatyczny ulegają reakcji nitrowania stężonym kwasem azotowym tworząc żółte pochodne nitrowe. Tyrozyna ulega tym reakcjom łatwo, tryptofan trudniej. Najtrudniejszy do zaobserwowania jest efekt dodatni tej reakcji dla fenyloalaniny.
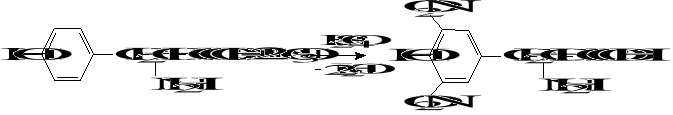
Aminokwasy aromatyczne dzięki obecności pierścienia aromatycznego pochłaniają światło o długości 280 nm co jest często wykorzystywane do oznaczeń ilościowych białek metodą kolometryczną.
Do 1 cm3 roztworu aminokwasu aromatycznego dodać 4 krople stężonego HNO3, a następnie 4 krople stężonego H2SO4. Po podgrzaniu występuje żółte zabarwienie pochodnych nitrowych. Roztwór po zalkalizowaniu roztworem 2M NaOH przyjmuje kolor brunatno-pomarańczowy.
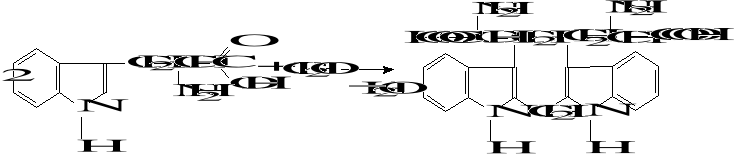
5. Wykrywanie tryptofanu
W środowisku kwaśnym tryptofan reaguje z aldehydami dając barwne produkty kondensacji. Najczęściej używa się aldehydu mrówkowego (reakcja Voisoneta) lub glioksalu (reakcja Adamkiewicza-Hopkinsa):

Reakcja Voisoneta
Do 1 cm3 roztworu tryptofanu dodać 2-3 krople 3% roztworu aldehydu mrówkowego i 2 cm3 stężonego HCl, wymieszać i pozostawić na około 5 minut. Następnie dodać kilka kryształków suchego NaNO2 lub KNO2.
Powstaje brunatne zabarwienie pochodzące od produktu sprzęgania.
6. Odczyn Pauliego na histydynę
Związki imidazolowe, w tym histydyna dają czerwone zabarwienie w reakcji diazowania z kwasem sulfanilowym. Odczynnik Pauliego składa się z trzech roztworów: kwasu sulfanilowego, azotynu sodu oraz węglanu sodowego, które zmieszane tworzą kwas diazobenzenosulfonowy.
W reakcji z tym samym odczynnikiem tyrozyna tworzy żółto-pomarańczowy (herbaciany) produkt reakcji diazowania.
Do 1 cm3 roztworu histydyny dodać kilka kropel świeżo przygotowanego odczynnika Pauliego (1 cm3 roztworu Pauli I, 1cm3 roztworu Pauli II i 2 cm3 roztworu Pauli III).
Dla porównania wykonujemy analogiczną reakcje dla tyrozyny (proporcje jak wyżej).
2. Identyfikacja dwóch aminokwasów
Ćwiczenie polega na identyfikacji dwóch aminokwasów na podstawie reakcji wymieniowych w poprzednim ćwiczeniu. W każdej z otrzymanych probówek znajduje się roztwór jednego z aminokwasów. Wykonując odpowiednie reakcje należy zidentyfikować otrzymane aminokwasy.
Schemat dołączony na końcu przedstawia tok postępowania przy analizie aminokwasów.
3. Chromatografia bibułowa aminokwasów
Celem ćwiczenia jest zapoznanie się z jedną z podstawowych metod chromatograficznych i jej wykorzystaniem praktycznym przy identyfikacji aminokwasów.
Na krążku bibuły Whatmana nr 1 zaznaczyć lekko ołówkiem środek krążka i podzielić go promieniście na 5 części, zaznaczyć ołówkiem podział. W odległości ok. 2 cm od zaznaczonego środka narysować okrąg - linię startu. Na linii startu nakropić pasemkami za pomocą kapilary roztwory 4 aminokwasów wzorcowych, a w 5 części analizowaną mieszaninę aminokwasów. W środek krążka włożyć zwinięty rulonik bibuły o długości około 1,5 cm.
Tak przygotowany chromatogram położyć na spodniej części szalki Petriego tak aby zwinięty pasek bibuły zanurzony był w 90% metanolu (układ rozwijający). Spodnią część szalki z położonym chromatogramem należy przykryć górną częścią szalki. Chromatogram po rozwinięciu (kiedy czoło rozpuszczalnika osiągnie wysokość ok. 1 cm od brzegu krążka), wysuszyć na powietrzu, a następnie wywołać 5% etanolowym roztworem ninhydryny, susząc go ponownie w suszarce w temp. około 60 °C. Przez porównanie zabarwienia oraz wartości współczynników Rf otrzymanych pasm aminokwasów badanej mieszaniny ustalić jakie aminokwasy wchodziły w jej skład.
Wykrywanie aminokwasu
A/ reakcja z formaldehydem
B/ reakcja z kwasem azotowym
C/ reakcja ninhydrynowa
kolor różowy-hydroksyprolina kolor niebiesko- fioletowy
kolor żółty - prolina inny aminokwas
Wykrywanie pierścienia aromatycznego
reakcja ksantoproteinowa
bezbarwny lub blado żółty roztwór kolor żółty,
po alkalizacji bezbarwny po alkalizacji pomarańczowy
-aminokwas niearomatyczny - aminokwas aromatyczny
lub histydyna
Wykrywanie tryptofanu
Reakcja Voisoneta
kolor żółty kolor brunatny
tyrozyna lub tryptofan
fenyloalanina
Wykrywanie histydyny i tyrozyny
Reakcja Pauliego
czerwono-wiśniowy kolor pomarańczowy kolor jasno żółty kolor
- histydyna -tyrozyna -inny aminokwas ( np. prolina, alanina)
1
9
1
10
Wyszukiwarka
Podobne podstrony:
sprawozdanie z biochemii z aminokwasĂłw, BIOCHEMIA
Budowa aminokwasow, Biochemia
Aminokwasy, BIOCHEMIA
Metabolizm aminokwasow, Biochemia, Pomoce;)
AMINOKWASY, Biochemia, Pomoce;)
aminokwasy biochemia
aminokwasy 2, BIOCHEMIA
Konspekt - Aminokwasy, biochemia, biochemiapros, zadania domowe
aminokwasy, biochemia
19 - dna pur pir aminokw, Biochemia - XIX
I koło- aminokwasy, BIOCHEMIA
Biochemia(ŻCz)Ćw1 Właściwości fizyko chemiczne aminokwasów
biochemia aminokwasy
więcej podobnych podstron