ZADANIA Z TECHNOLOGII CHEMICZNEJ
Przykład 1
Chlorek metylu otrzymuje się w procesie chlorowania metanu gazowym chlorem (strumień WB). Strumień WA oprócz metanu zawiera azot (2 % molowe).
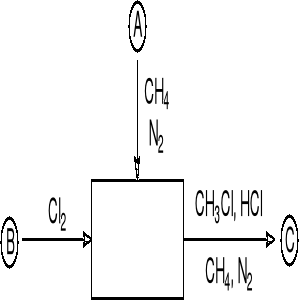
Proces chlorowania metanu prowadzi się stosując nadmiar metanu w stosunku do chloru. W reakcji:
CH4 + Cl2 = CH3Cl + HCl
chlor zużywa się całkowicie.
Wydajność przetwarzania metanu w chlorek metylu wynosi
![]()
0≤ η≤1
Oblicz zależność ułamka molowego CH3Cl w strumieniu WC od wydajności procesu η.
aCH3Cl = f(η)
Rozwiązanie
Za podstawę bilansu przyjęto natężenie strumienia zawierającego metan i 2 % molowe azotu: WA = 100 kmol/h.
Na podstawie przyjętej podstawie bilansu obliczamy natężenie strumienia metanu w gazie zasilającym reaktor WA[CH4]. Wynosi on 98 kmol/h. Azot stanowi resztę strumienia tj. 2 kmol/h.
Z definicji ၨ obliczamy zawartość CH3Cl w strumieniu C: WC[CH3Cl] = WA[CH4] Ⴗ ၨ
czyli
WC[CH3Cl] = 98 ၨ
Z bilansu węgla (C) obliczamy zawartość metanu w strumieniu C:
WA[CH4] = WC[CH4] + WC[CH3Cl]
WC[CH4] = 98 - 98 ၨ = 98(1-ၨ)
Z bilansu wodoru obliczamy natężenie strumienia HCl w gazach po reakcji.
4 WA[CH4] = 4 WC[CH4] + 3WC[CH3Cl] + WC[HCl]
WC[HCl] = 4 WA[CH4] - 4 WC[CH4] - 3WC[CH3Cl]
WC[HCl] = 98ၨ
Zawartość chloru w strumieniu A obliczamy na podstawie bilansu chloru:
2WA[Cl2] = WC[CH3Cl] + WC[HCl]
WA[Cl2] = 98ၨ
Ponieważ azot nie bierze udziału w reakcji natężenie strumienia WA[N2] jest identyczne jak w strumieniu C:
WA[N2] = WC[N2]
Bilans reaktora przedstawiono w tabeli 1.
Tabela 1. Bilans masy
Przychód, kmol/h |
Rozchód, kmol/h |
CH4 98 |
CH4 98 (1 - )
|
N2 2 |
N2 2
|
Cl2 98 |
CH3Cl 98 |
|
HCl 98 |
|
100 + 98 = WC |
![]()
Ułamek molowy chlorku metylu w strumieniu C obliczamy ze wzoru:
![]()
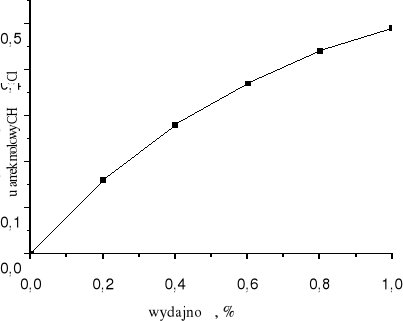
Wartość η może zmieniać się od 0 do 1. Jeżeli η = 0, ułamek molowy chlorku metylu w strumieniu C wynosi 0. Ze wzrostem wydajności rośnie ułamek molowy chlorku metylu w strumieniu C. Dla maksymalnej wydajności (η = 1) wynosi on 0,495.
Przykład 2
Utlenianie SO2 prowadzi się na katalizatorach wanadowych. Do reaktora doprowadza się gazy uzyskane ze spalania siarki o składzie (w procentach molowych) 10 %, SO2, 11 % O2 i 79 % N2. Stopień przemiany SO2 w SO3 uzyskiwany na katalizatorze oznacza się x i definiuje
x =![]()
Zawartość SO2 w gazach poreakcyjnych wynosi a (% mol.). Schemat instalacji:
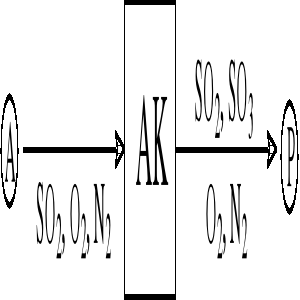
Przyjmując za podstawę bilansu natężenie strumienia A: WA = 100 kmol/h wyznacz i przedstaw graficznie zależność a = f(x)
Rozwiązanie
Za podstawę bilansu przyjęto natężenie strumienia A (WA = 100 kmol/h) zawierającego 10 % SO2, 11 % O2 i 79 % N2 (% molowe).
Na podstawie przyjętej podstawy bilansu zawartość SO2, O2 i N2 w strumieniu A wynosi odpowiednio 10, 11 i 79 kmol/h.
Z definicji stopnia przemiany SO2 do SO3 obliczono zawartość SO3 w strumieniu P: WP[SO3] = WA[SO2] Ⴗ x
czyli:
WP[SO3] = 10 x
Z bilansu siarki (S) obliczamy zawartość SO2 w strumieniu P:
WA[SO2] = WP[SO3] + WP[SO2]
WP[SO2] = 10 - 10x = 10(1-x)
Zawartość tlenu w strumieniu P (WP[SO2]) obliczamy z bilansu tlenu:
2WA[SO2] + 2WA[O2] = 3WP[SO3] + 2WP[SO2] + 2WP[O2]
Ponieważ azot nie bierze udziału w reakcji natężenie strumienia WA[N2] jest identyczne jak w strumieniu P:
WA[N2] = WP[N2]
Bilans reaktora przedstawiono w tabeli 2.
Tabela 2. Bilans masy
Przychód, kmol/h |
Rozchód, kmol/h |
SO2 10 |
SO2 10(1-x)
|
N2 79 |
N2 79
|
O2 11 |
SO3 10x |
|
O2 11- 5x |
|
100 - 5x = WP |
Procent molowy SO2 w strumieniu P wynosi:
![]()
, %
![]()
, %
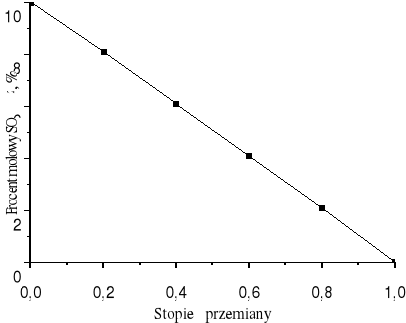
Wartość stopnia przemiany dwutlenku siarki (IV) do dwutlenku siarki (VI) może zmieniać się od 0 do 1. Jeżeli stopień przemiany wynosi 0 procent molowy SO2 w strumieniu P wynosi 10 czyli tyle ile w strumieniu A. Ze wzrostem x maleje zawartość SO2 w strumieniu P. Dla x = 1 w strumieniu P występuje wyłącznie SO3, azot i nieprzereagowany tlen.
Przykład 3
Synteza amoniaku z wodoru i azotu
3H2 + N2 = 2NH3
jest reakcją odwracalną i egzotermiczną, której stała równowagi maleje ze wzrostem temperatury. Ze wzrostem temperatury maleją więc także równowagowe stopnie przemiany wodoru i azotu. W celu uzyskania odpowiednich szybkości reakcji syntezy NH3 stosuje się katalizator żelazowy, który jest aktywny w zakresie temperatury 400-500 0C. W tym zakresie temperatury wartość stałej równowagi jest mała. W celu zwiększenia równowagowego stopnia przemiany w praktyce przemysłowej stosuje się ciśnienie 10-30MPa. W tych warunkach zawartość amoniaku w gazie opuszczającym reaktor nie przekracza 20 % mol.
Gaz do syntezy amoniaku zawiera, oprócz głównych składników tj. azotu i wodoru, również niewielkie ilości (ok. 2%) gazów obojętnych głównie metanu i argonu (argon pochodzi z powietrza). W celu maksymalnego wykorzystania substratów proces syntezy amoniaku prowadzi się w układzie zamkniętym z recyrkulacją gazu po wydzieleniu z niego otrzymanego amoniaku.
Syntezę amoniaku prowadzi się w reaktorze, do którego doprowadza się wodór i azot z domieszką argonu. Ułamek molowy argonu w strumieniu A wynosi 0,02. Stosunek molowy wodoru do azotu w strumieniu A wynosi 2,7. Przyjmując, że do instalacji doprowadza się 100 kmol/h gazu (WA = 100 kmol/h) oblicz zależność ułamka molowego amoniaku w strumieniu B od stopnia przemiany wodoru w reaktorze (aNH3 = f(x)), 0 Ⴃ x Ⴃ 0,2).
![]()
Rozwiązanie
Na podstawie przyjętej podstawy bilansu natężenie strumienia argonu (WA[Ar]) wynosi 2 kmol/h.
Natężenie strumienia wodoru i azotu w strumieniu A wynosi 98 kmol/h. Stosunek natężenia strumienia wodoru do azotu wynosi 2,7.
WA[H2] + WA[N2] = 98
WA[H2] /WA[N2] = 2,7
czyli:
WA[H2] = 71,5 kmol/h i WA[N2] = 26,5 kmol/h
Wykorzystując definicję stopnia przemiany wodoru w reaktorze obliczamy natężenie strumienia wodoru w gazie po reakcji:
WB[H2] = WA[H2](1-x) = 71,5(1-x)
Natężenie strumienia wyprodukowanego amoniaku obliczamy z bilansu wodoru w obszarze reaktora:
2WA[H2] = 2WB[H2] + 3WB[NH3]
a stąd
WB[NH3] = 47,7x
Natężenie strumienia nieprzereagowanego azotu (WB[N2]) obliczamy na podstawie bilansu azotu:
2WA[N2] = 2WB[N2] + WB[NH3]
z czego wynika:
WB[N2] = 26,5 - 23,9x
Ponieważ argon nie bierze udziału w reakcji natężenie strumienia WA[Ar] jest identyczne jak w strumieniu B:
WB[Ar] = WB[Ar]
WB[Ar] = 2
Bilans reaktora przedstawiono w tabeli 3.
Tabela 3. Bilans masy
Przychód, kmol/h |
Rozchód, kmol/h |
H2 71,5 |
H2 71,5(1-x)
|
N2 26,5 |
N2 26,5-23,9x
|
Ar 2 |
Ar 2 |
|
NH3 47,7x |
|
100 - 47,7x = WB |
Zależność ułamka molowego amoniaku w strumieniu B od stopnia przemiany wodoru obliczamy ze wzoru:
![]()
z którego wynika:
![]()
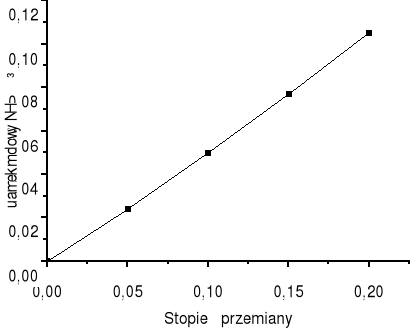
Dla wartości stopnia przemiany wodoru równego 0 w reaktorze nie zachodzi reakcja i skład strumienia B jest taki jak strumienia A. Wraz ze wzrostem wartości stopnia przemiany wodoru zawartość amoniaku w strumieniu B wzrasta. Dla x = 0,2 ułamek molowy amoniaku w gazie po reakcji wynosi 0,105.
Przykład 4
Chlorek potasu otrzymuje się z wodnego roztworu sylwinitu (sól, w której potas występuje w postaci minerału - sylwinu) zawierającego 35 % mas. KCl. W procesie krystalizacji otrzymuje się czysty KCl oraz roztwór pokrystalizacyjny zawierający a % mas. KCl. Oblicz zależność wydajności krystalizacji od stężenia KCl w roztworze pokrystalizacyjnym.
ၨ = f(a)
ၨ = ![]()
Obliczenia prowadź zakładając, że w ciągu 1 godziny przerabia się 1000 kg roztworu sylwinitu
(GA = 1000 kg/h).
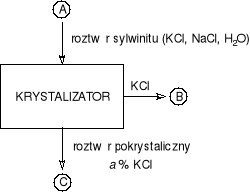
Rozwiązanie
Natężenie strumienia KCl w roztworze sylwinitu (GA[KCl]) wynosi:
GA[KCl] = 0,35GA
czyli:
GA[KCl] = 350 kg/h
Natężenie strumieniu wody i NaCl w roztworze sylwinitu wynosi 650 kg/h.
Natężenie strumienia otrzymywanego KCl (GB[KCl]) obliczamy z wydajności procesu (ၨ = GB[KCl]/GA[KCl]).
Podstawiając otrzymujemy:
GB[KCl] = 350ၨ
Natężenie strumienia KCl w roztworze pokrystalizacyjny obliczamy z bilansu KCl w obszarze krystalizatora:
GA[KCl] = GB[KCl] + GC[KCl]
z czego wynika:
GC[KCl] = 350(1-ၨ)
W roztworze pokrystalizacyjnym natężenie strumienia wody i NaCl wynosi 650 kg/h.
Bilans reaktora przedstawiono w tabeli 4.
Tabela 4. Bilans masy
Przychód, kg/h |
Rozchód, kg/h |
KCl 350 |
B: KCl 350ၨ |
NaCl +H2O 650 |
C: KCl 350(1-ၨ) |
|
NaCl +H2O 650 |
Procent masowy KCl w strumieniu C wynosi:
![]()
, %
stąd wynika:
![]()
, %
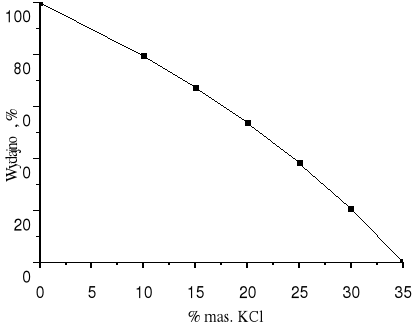
Wydajność krystalizacji może zmieniać się od 0 do 100 %. 35 % KCl w strumieniu C oznacza, że wydajność procesu wynosi 0 (KCl nie wykrystalizował). W tym przypadku skład strumienia C jest taki sam jak strumienia A. Wartość ၨ wzrasta do 100 % gdy w strumieniu C nie występuje KCl.
Przykład 5
Prażąc piryt FeS2 w strumieniu powietrza otrzymuje się gaz zawierający SO2, O2 i N2 oraz wypałki - Fe2O3. Przyjmując, że ułamek molowy tlenu w strumieniu P wynosi ![]()
(![]()
= WP[O2]/WP) i ułamek molowy SO2 w strumieniu P wynosi ![]()
(![]()
= WP[SO2]/WP), oblicz zależność ![]()
= f(![]()
). Obliczenia przeprowadź przyjmując za podstawę bilansu 10 kmol/h gazu opuszczającego reaktor (WP = 10 kmol/h).
Uproszczony skład powietrza: 20 % tlenu i 80 % azotu.
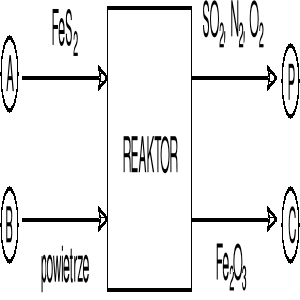
Rozwiązanie
Na podstawie przyjętej podstawy bilansu zawartość dwutlenku siarki (IV) w strumieniu P wynosi 10![]()
kmol/h. Zawartości tlenu i azotu w strumieniu P wynoszą odpowiednio:
10![]()
i 10![]()
.
Z bilansu siarki w obszarze reaktora obliczamy natężenie strumienia pirytu FeS2 :
2WA[FeS2] =WP[SO2]
WA[FeS2] = 0,5WP[SO2]
Z bilansu żelaza w obszarze reaktora obliczamy natężenie strumienia Fe2O3 :
WA[FeS2] =2WCFe2O3]
WC[Fe2O3] = 0,5WA[FeS2] = 2,5![]()
Zawartość tlenu w strumieniu B (WB[O2]) obliczamy z bilansu tlenu:
2WB[O2] = 2WP[SO2] + 2WP[O2] +3WC[Fe2O3]
stąd
WB[O2] = 13,75![]()
+ 10![]()
Ponieważ azot nie bierze udziału w reakcji natężenie strumienia WB[N2] jest identyczne jak w strumieniu P:
WB[N2] = WP[N2]
WB[N2] = 10(1-![]()
-![]()
)
Bilans reaktora przedstawiono w tabeli 5.
Tabela 5. Bilans masy
Przychód, kmol/h |
Rozchód, kmol/h |
FeS2 5 |
SO2 10
|
N2 10(1- |
N2 10(1-
|
O2 13,75 |
O2 10 |
|
Fe2O3 2,5 |
Zależność ułamka molowego dwutlenku siarki od ułamka molowego tlenu w strumieniu P obliczamy z zależności:
![]()
= 4
czyli:
![]()
= 0,154 - 0,77aO2
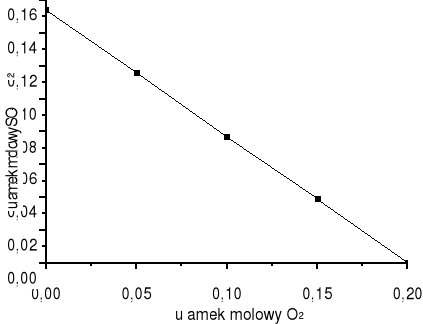
Wartość ułamka molowego SO2 w strumieniu P może zmieniać się od 0 do 0,154. Gdy ![]()
= 0 oznacza to, że reakcja nie zachodzi i skład strumienia P jest taki jak strumienia B (powietrze). Dla ![]()
= 0 wartość ułamka molowego SO2 wynosi 0,154. Oznacza to, że do reaktora wprowadzono stechiometryczną ilość FeS2 i tlenu. W praktyce stosuje się nadmiar tlenu.
Przykład 6
Gaz zawierający CO, CO2, H2 i N2 poddaje się konwersji parą wodną w celu wzbogacenia go w wodór. Reakcja konwersji zachodzi w/g równania
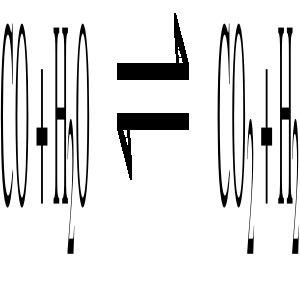
W procesie stosuje się nadmiar pary wodnej. Z gazów po konwersji usuwa się nieprzereagowaną parę wodną (strumień C). Uproszczony schemat instalacji przedstawia rysunek.
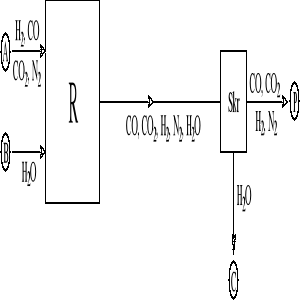
Przyjmując skład strumienia A: H2 — 34 %, CO — 37 %, CO2 — 4 %, N2 — 25% molowych i stosunek natężenia strumienia pary wodnej (strumień B) do strumienia A: WB/WA = 1,5 oraz stopień przemiany (konwersji) tlenku węgla (II) w reaktorze 90 % oblicz ułamki molowe wodoru, tlenku węgla (II) i tlenku węgla (IV) w strumieniu P. Za podstawę bilansu należy przyjąć natężenie strumienia A: WA = 100 kmol/h.
Rozwiązanie
Na podstawie przyjętej podstawy bilansu natężenie strumienia wodoru, tlenku węgla (II), tlenku węgla (IV) i azotu w gazie wprowadzanym do reaktora wynosi odpowiednio:
WA[H2] = 34 kmol/h
WA[CO] = 37 kmol/h
WA[CO2] = 4 kmol/h
WA[N2] = 25 kmol/h
Z zależności:
![]()
= 1,5
obliczamy natężenie strumienia WB
WB[H2O] = 150 kmol/h
Z definicji stopnia przemiany CO:
x = ![]()
możemy obliczyć WD[CO]
WD[CO] = WA[CO](1-x) = 37 Ⴗ 0,1 = 3,7 kmol/h
WP[CO] jest równe natężeniu strumienia CO w strumieniu D (WD[CO]).
WP[CO] = WD[CO]
WP[CO] = 3,7 kmol/h
Natężenie strumienia CO2 w gazie po konwersji obliczamy z bilansu węgla.
WA[CO] + WA[CO2] = WP[CO] + WP[CO2]
stąd
WP[CO2] = 37,3 kmol/h
Natężenie strumienia nieprzereagowanej pary wodnej obliczamy z bilansu tlenu.
WA[CO] + 2WA[CO2] + WB[H2O] = WP[CO] + 2WP[CO2] + WC[H2O]
WC[H2O] = WA[CO] + 2WA[CO2] + WB[H2O] - WP[CO] - 2WP[CO2]
czyli
WC[H2O] = 116,7 kmol/h
Natężenie strumienia wodoru w strumieniu P obliczamy z bilansu wodoru.
2WA[H2] + 2WB[H2O] = 2WP[H2] + 2WC[H2O]
WP[H2] = WA[H2] + WB[H2O] - WC[H2O]
czyli
WP[H2] = 67,3 kmol/h
Bilans reaktora przedstawiono w tabeli 6.
Tabela 6. Bilans masy
Przychód, kmol/h |
Rozchód, kmol/h |
H2 34 |
H2 67,3
|
N2 25 |
N2 25 |
CO2 4 |
CO2 37,3 |
CO 37 |
CO 3,7 |
H2O 150 |
H2O 116,7 |
Ułamki molowe wodoru, tlenku węgla (II) i tlenku węgla (IV) w strumieniu P wynoszą:
![]()
= 0,50
![]()
= 0,03
![]()
= 0,28
Przykład 7
Stężony kwas siarkowy (95 % mas.) otrzymuje się przez absorpcję SO3 w wieży zasilanej H2SO4 o stężeniu b % (strumień C). Strumień C powstaje przez zmieszanie strumienia A (90% H2SO4) ze strumieniem D zawierającym kwas siarkowy (90%). Stosunek natężenia strumienia zawracanego D do natężenia strumienia B wynosi n (GD/GB = n, kg/h/kg/h). Przyjmując za podstawę bilansu 100 kg 95 % H2SO4/h (GB = 100 kg/h) znajdź zależność pomiędzy stężeniem b % kwasu siarkowego zasilającego wieżę (b % mas.) i n (b = f(n)).
Masy molowe:
H2SO4 - 98 kg/kmol
H2O - 18 kg/kmol
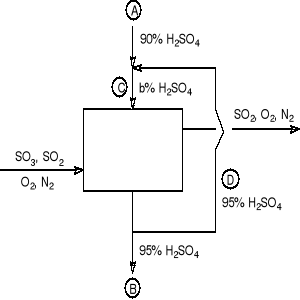
Rozwiązanie
Wodór w strumieniu B pochodzi wyłącznie ze strumienia A (z wody i kwasu). Na podstawie bilansu wodoru (w kg/h) w obszarze zewnętrznym można obliczyć wielkość strumienia A.
0,9GA 2/98 + 0,1GA 2/18 = 0,95GB 2/98 + 0,05GB 2/18
czyli:
GA = 84,62 kg/h
W obszarze 1, w którym mieszają się strumienie A i D, w wyniku czego powstaje kwas siarkowy o stężeniu b % (strumień C), przeprowadzamy bilans wodoru:
0,1GAႷ2/18 +0,9GAႷ 2/98+0,05GDႷ2/18+0,95GDႷ 2/98 = (GA+GD)Ⴗ0,01bႷ2/98+(GA+GD)Ⴗ(1- 0,01b)Ⴗ2/18
Z definicji n wynika, że:
GD = GB Ⴗ n
Ponieważ
GB = 100 kg/h (przyjęta podstawa bilansu)
a zatem
GD = 100n
Po podstawieniu GA = 84,62 kg/h i GD = 100 n otrzymujemy:
b = (76,158 + 95n)/ (0,8462 + n)
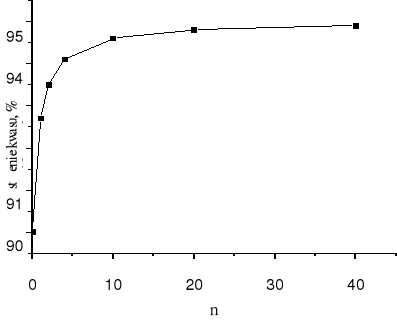
Jeżeli n = 0, na wieżę wprowadza się kwas siarkowy (VI) o stężeniu 90 %. Ze wzrostem n rośnie stężenie wprowadzanego na wieżę H2SO4. Dla n → ∞, stężenie kwasu siarkowego wprowadzanego na wieżę dąży do 95 %.
Przykład 8
W procesie półspalania metanu w tlenie powstaje: acetylen, etylen, wodór, para wodna, tlenek i dwutlenek węgla oraz sadza. Gaz po procesie zawiera również nieprzereagowany metan. Całkowity stopień przemiany metanu wynosi 95 %. Stężenie metanu w mieszaninie z tlenem (strumień WA) wynosi 62 % objętościowych. Uproszczony schemat procesu przedstawiono na rysunku:
Stosunek molowy powstałego tlenku węgla do nieprzereagowanego metanu wynosi 10 (WE[CO]/WE[CH4] = 10). Stopień przemiany metanu w sadzę wynosi 2 % (WD[C]/WA[CH4] = 0,02). Stosunek powstałej w reaktorze pary wodnej do tlenku węgla wynosi 1 (WD[H2O]/WE[CO] = 1).
Przyjmując za podstawę bilansu 100 kmol/s strumienia WA oblicz zależność ułamka molowego acetylenu (a) w strumieniu WE od n (n - stosunek molowy wytworzonego acetylenu do sadzy (WE[C2H2]/ WD[C]= n).
Rozwiązanie
Stężenie metanu w mieszaninie z tlenem (strumień WA) wynosi 62 % objętościowych. Natężenie strumienia metanu i tlenu w gazie wprowadzanym do reaktora wynosi odpowiednio 62 i 38 kmol/s. Stopień przemiany metanu wynosi 95 % czyli:
![]()
= 0,95
czyli:
WE[CH4] = 3,1
Ponieważ WE[CO]/WE[CH4] = 10, po podstawieniu otrzymujemy:
WE[CO] = 31
Stosunek natężenia strumienia pary wodnej (WD[H2O]) do natężenia strumienia tlenku węgla (II) (WE[CO]) wynosi 1, czyli
WD[H2O] = 31
Z zależności WD[C]/WA[CH4] = 0,02 otrzymujemy WD[C] = 1,24
Ponieważ WE[C2H2]/ WD[C] = n, po podstawieniu otrzymujemy
WE[C2H2] = 1,24n
Natężenie strumienia dwutlenku węgla (IV) obliczamy z bilansu tlenu:
2WA[O2] = WD[H2O] + WE[CO] + 2WE[CO2]
stąd
WE[CO2] = 7
Natężenie strumienia C2H4 obliczamy z bilansu węgla:
WA[CH4] = WE[CH4] + WD[C] + WE[CO] + WE[CO2] + 2WE[C2H2] + 2WE[C2H4]
czyli
WE[C2H4] = 9,83 - 1,24n
Natężenie strumienia wodoru WE[H2] otrzymujemy z bilansu wodoru:
4WA[CH4] = 4WE[CH4] + 2WE[C2H2] + 4WE[C2H4] + 2WD[H2O] + 2WE[H2]
WE[H2] = 67,14 + 1,24n
Bilans reaktora przedstawiono w tabeli 7.
Tabela 7. Bilans masy
P, kmol/s R, kmol/s
CH4 62 CH4 3,10
H2O 31
O2 38 C 1,24 C2H2 1,24n CO 31
CO2 7
C2H4 9,83 - 1,24n (0 Ⴃn<7,92)
H2 67,14 + 1,24n
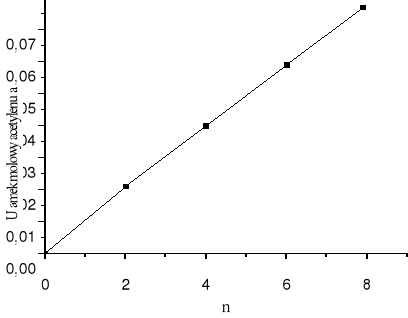
Zależność ułamka molowego acetylenu (a) w strumieniu WE od n obliczamy ze wzoru:
a = ![]()
a = ![]()
WE
CO, CO2, H2, CH4
C2H2, C2H4
REAKTOR
FILTR
WA
CH4, O2
C (sadza), H2O
WD
WB
Wyszukiwarka
Podobne podstrony:
8197
8197
8197
8197
0airkolokwiumwyklad 1id 8197
8197
8197
więcej podobnych podstron