Hodowla muszki owocowej
(Drosophila melanogaster)
Uniwersytet Technologiczno-Przyrodniczy w Bydgoszczy
Wydział: Rolnictwa i Biotechnologii
Kierunek: Rolnictwo
Grupa: II
Zespół: V
Patryk Kuźnik
Paweł Mietła
Michał Murawski
Karolina Ochocka
1.Wstęp

Rząd: Diptera (muchówki, dwuskrzydłe)
Rodzina: Drosophiliadae (wywilżanki)
Rodzaj: Drosophila
Gatunek: Drosophila melanogaster (muszka owocowa)
Drosophila melanogaster
Muszka owocowa (Drosophila melanogaster) była i nadal jest idealnym materiałem do badań genetycznych. Jest to spowodowane: niewielkimi rozmiarami ciała muszki owocowej, małą liczbą chromosomów, łatwością utrzymywania i hodowania w warunkach laboratoryjnych, dużą płodnością, krótkim okresem rozwoju jaja do dorosłego owada, możliwością uzyskiwania dużych populacji oraz licznych pokoleń w krótkim czasie (50 pokoleń w ciągu roku), różnorodnością mutacji występujących u tego gatunku. Jest ona najlepiej zbadanym organizmem pod względem genetycznym. Dorosłe osobniki wielkości ok. 3mm posiadają widoczne, łatwe do obserwacji cechy fenotypowe, takie jak barwa i kształt oczu, kształt i długość skrzydeł, barwa ciała (tułowia i odwłoka), liczba włosków na powierzchni ciała. Drosophila melanogaster jest rozdzielnopłciowa o wyraźnie zaznaczonym dymorfizmie płciowym. Garnitur chromosomów (2n=8) składa się z 8 chromosomów, tj. 6 autosomów i 2 heterochromosomów. Samica posiada dwa chromosomy X, samiec chromosomy XY.
samica ♀ |
samiec ♂ |
większa od samca, mniej ruchliwa |
mniejszy od samicy, aktywniejszy |
odwłok duży, pękaty, jasny (zwłaszcza część brzuszna) |
odwłok mały, skrócony, zaokrąglony |
ciemne paski na odwłoku od strony grzbietowej są dobrze widoczne |
ciemne paski zlewając się ze sobą przy końcu odwłoka tworzą ciemną plamę |
brak grzebyka płciowego |
obecność grzebyka płciowego |
2. Materiał i metoda
Hodowla I:
Normal (N)- szare ciało, czerwone oczy, długie skrzydła
sepia (se)- szare ciało, granatowe oczy, długie skrzydła
Normal sepia
Hodowla II:
Normal (N)- szare ciało, czerwone oczy, długie skrzydła
yellow (y)- żółte ciało, czerwone oczy, długie skrzydła
Normal yellow
17.10.2011r. - izolowanie poczwarek do I hodowli
Wyizolowaliśmy po 10 poczwarek szczepu Normal i sepia. Pojedyncze poczwarki z określonych linii przenieśliśmy do malutkich buteleczek z pożywką. Poczwarki umieściliśmy delikatnie na ściankach buteleczek tuż nad pożywką. Buteleczki opisaliśmy podając nazwy szczepów.
24.10.2011r. -założenie I hodowli
Do pierwszej butelki hodowlanej wpuściliśmy dwie samice szczepu Normal i dwa samce szczepu sepia (N x se). Do drugiej butelki hodowlanej wpuściliśmy dwie samice szczepu sepia i dwa samce szczepu Normal (se x N). Założone hodowle dokładnie opisaliśmy na kolbie, podając nazwy kojarzonych szczepów i datę założenia hodowli.
7.11.2011r. -izolowanie poczwarek do II hodowli
Wyizolowaliśmy po 8 poczwarek szczepu Normal i yellow. Pojedyncze poczwarki z określonych linii przenieśliśmy do malutkich buteleczek z pożywką. Poczwarki umieściliśmy delikatnie na ściankach buteleczek tuż nad pożywką. Buteleczki opisaliśmy podając nazwy szczepów.
14.11.2011r.
a) założenie II hodowli
Do pierwszej butelki hodowlanej wpuściliśmy dwie samice szczepu Normal i dwa samce szczepu yellow (N x y). Do drugiej butelki hodowlanej wpuściliśmy dwie samice szczepu yellow i dwa samce szczepu Normal (y x N). Założone hodowle dokładnie opisaliśmy na kolbie, podając nazwy kojarzonych szczepów i datę założenia hodowli.
b) założenie na F2
Muszki z butelek hodowlanych z I hodowli przesypaliśmy do butelek hodowlanych ze świeżą pożywką. Butelki dokładnie opisaliśmy.
21.11.2011r.
a)analiza pokolenia F1
Muszki z butelek hodowlanych z I hodowli przesypaliśmy do czystych butelek- bez pożywki i zamknęliśmy korkami z waty zwilżonymi eterem. Śpiące muszki wysypaliśmy na białą kartkę papieru. Dokonaliśmy podziału pod względem barwy oczu i płci.
b)wypuszczenie rodziców z II hodowli
Z butelek hodowlanych do II hodowli wypuściliśmy rodziców, aby nie doszło do wstecznego kojarzenia z potomstwem.
5.12.2011r.
a)analiza I hodowli
Muszki z butelek hodowlanych z I hodowli przesypaliśmy do czystych butelek- bez pożywki i zamknęliśmy korkami z waty zwilżonymi eterem. Śpiące muszki wysypaliśmy na białą kartkę papieru. Dokonaliśmy podziału pod względem barwy oczu i płci.
b)analiza II hodowli
Muszki z butelek hodowlanych z II hodowli przesypaliśmy do czystych butelek- bez pożywki i zamknęliśmy korkami z waty zwilżonymi eterem. Śpiące muszki wysypaliśmy na białą kartkę papieru. Dokonaliśmy podziału pod względem barwy ciała i płci.
3.Wyniki
Hodowla I - -dziedziczenie jednej pary cech autosomalnych
Uzyskane osobniki z wyizolowanych poczwarek
|
N |
se |
imago |
3 |
1 |
zagrzybione |
1 |
6 |
martwe |
0 |
0 |
niewyklute |
6 |
3 |
Liczba osobników (podział na płci) użytych do krzyżowania
rodzaj krzyżowania |
jedna para cech autosomalnych |
||||
zapis krzyżowania |
♀ |
♂ |
♀ |
♂ |
|
|
(se x N) F1 |
(N x se) F1 |
|||
płeć |
♀ |
2 |
2 |
||
|
♂ |
2 |
2 |
||
Analiza fenotypowa pokolenia F1 (podział na płci)
płeć |
♀ |
♂ |
♀ |
♂ |
||||
zapis krzyżowania |
(N x se) F1 |
(se x N) F1 |
||||||
fenotyp pokolenia F1 |
czerwone oczy |
|
czerwone oczy |
|
||||
płeć |
♀ |
♂ |
|
|
♀ |
♂ |
|
|
liczba osobników |
34 |
30 |
|
|
23 |
14 |
|
|
suma |
64 |
|
37 |
|
||||
Analiza fenotypowa pokolenia F2 (podział na płci)
płeć |
♀ |
♂ |
♀ |
♂ |
||||
zapis krzyżowania |
(se x N) F2 |
(N x se) F2 |
||||||
fenotyp pokolenia F2 |
granatowe oczy |
czerwone oczy |
czerwone oczy |
granatowe oczy |
||||
płeć |
♀ |
♂ |
♀ |
♂ |
♀ |
♂ |
♀ |
♂ |
liczba osobników |
5 |
2 |
19 |
30 |
8 |
10 |
0 |
0 |
suma |
7 |
49 |
18 |
0 |
||||
Założenia:
se+ - czerwone oczy
se - granatowe oczy
(N x se)F1
P1:![]()
x ![]()
czerwone granatowe
oczy oczy
gamety: ![]()
; ![]()
F1: ![]()
czerwone
oczy
Hipoteza: Płeć w pokoleniu potomnym dziedziczy się w stosunku 1:1.
fo |
płeć |
frekwencja |
fe |
34 |
samice |
1 |
32 |
30 |
samce |
1 |
32 |
64/2=32 |
|
2 |
|
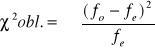
![]()
v= n-1
v=2-1=1
α=0,05
![]()
![]()
Założona hipoteza, że płeć w pokoleniu potomnym dziedziczy się w stosunku 1:1 jest słuszna.
(se x N)F1
P1: ![]()
x ![]()
granatowe czerwone
oczy oczy
gamety: ![]()
; ![]()
F1: ![]()
czerwone
oczy
Hipoteza: Płeć w pokoleniu potomnym dziedziczy się w stosunku 1:1.
fo |
płeć |
frekwencja |
fe |
23 |
samice |
1 |
18,5 |
14 |
samce |
1 |
18,5 |
37/2=18,5 |
|
2 |
|
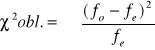
![]()
v= n-1
v=2-1=1
α=0,05
![]()
![]()
Założona hipoteza, że płeć w pokoleniu potomnym dziedziczy się w stosunku 1:1 jest słuszna.
P2: ![]()
X ![]()
czerwone czerwone
oczy oczy
gamety: ![]()
, ![]()
; ![]()
, ![]()
F2: ![]()
![]()
![]()
![]()
czerwone czerwone czerwone granatowe
oczy oczy oczy oczy
(N x se) F2
Hipoteza: Badane cechy dziedziczą się wg Pisum.
fo |
fenotyp |
frekwencja |
fe |
49 |
czerwone oczy |
3 |
42 |
7 |
granatowe oczy |
1 |
14 |
56/4=14 |
|
4 |
|
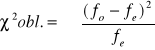
![]()
v= n-1
v=2-1=1
α=0,05
![]()
![]()
Założona hipoteza, że badane cechy dziedziczą się wg Pisum nie została potwierdzona.
(se x N) F2
Hipoteza: Badane cechy dziedziczą się wg Pisum.
fo |
fenotyp |
frekwencja |
fe |
18 |
czerwone oczy |
3 |
13,5 |
0 |
granatowe oczy |
1 |
4,5 |
18/4=4,5 |
|
4 |
|
Liczebność jednej z hipotetycznych klas fenotypowych jest mniejsze niż 5, dlatego też dalszych obliczeń nie prowadzimy.
Hodowla II - dziedziczenie cechy sprzężonej z płcią- barwa ciała
Uzyskane osobniki z wyizolowanych poczwarek
|
N |
y |
imago |
1 |
1 |
zagrzybione |
7 |
7 |
martwe |
0 |
0 |
niewyklute |
1 |
1 |
Liczba osobników (podział na płci) użytych do krzyżowania
rodzaj krzyżowania |
cecha sprzężona z płcią |
||||
zapis krzyżowania |
♀ |
♂ |
♀ |
♂ |
|
|
(N x y) F1 |
(y x N) F1 |
|||
płeć |
♀ |
2 |
2 |
||
|
♂ |
2 |
2 |
||
Analiza fenotypowa pokolenia F1 (podział na płci)
płeć |
♀ |
♂ |
♀ |
♂ |
||||
zapis krzyżowania |
(N x y) F1 |
(y x N) F1 |
||||||
fenotyp pokolenia F2 |
szare ciało |
|
żółte ciało |
szare ciało |
||||
płeć |
♀ |
♂ |
|
|
♀ |
♂ |
♀ |
♂ |
liczba osobników |
20 |
14 |
|
|
0 |
22 |
24 |
0 |
suma |
34 |
|
22 |
24 |
||||
Założenia:
y+ -szare ciało
y -żółte ciało
(N x y) F1
P: ♀![]()
X ♂ ![]()
szare ciało żółte ciało
gamety:![]()
; ![]()
, ![]()
F1: ![]()
![]()
♀ szare ciało ♂ szare ciało
Hipoteza: Płeć w pokoleniu potomnym dziedziczy się w stosunku 1:1 (cecha sprzężona z płcią).
fo |
fenotyp |
frekwencja |
fe |
20 |
samice |
1 |
17 |
14 |
samce |
1 |
17 |
34/2=17 |
|
2 |
|
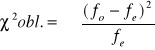
![]()
v= n-1
v=2-1=1
α=0,05
![]()
![]()
Założona hipoteza, że płeć w pokoleniu potomnym dziedziczy się w stosunku 1:1 jest słuszna.
(y x N)F1
P: ♀![]()
X ♂ ![]()
żółte ciało szare ciało
gamety: ![]()
; ![]()
, ![]()
F1: ![]()
![]()
♀ szare ciało ♂ żółte ciało
Hipoteza: Płeć w pokoleniu potomnym dziedziczy się w stosunku 1:1 (cecha sprzężona z płcią).
fo |
fenotyp |
frekwencja |
fe |
24 |
samice |
1 |
23 |
22 |
samce |
1 |
23 |
46/2=23 |
|
2 |
|
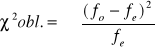
![]()
v= n-1
v=2-1=1
α=0,05
![]()
![]()
Założona hipoteza, że płeć w pokoleniu potomnym dziedziczy się w stosunku 1:1 jest słuszna.
4.Dyskusje i wnioski
Samce różnią się od samic składem heterochromosomów. Różnica polega na tym, że samice posiadają w każdej komórce dwa tak samo wyglądające chromosomy X, natomiast samce w swoich komórkach posiadają jeden chromosom X i jeden chromosom Y. W czasie gametogenezy do komórki rozrodczej dostaje się tylko jeden chromosom płciowy. W oogenezie jest to i tak chromosom X. U samców w spermatogenezie do plemnika wchodzi albo chromosom X albo chromosom Y. Samce więc chromosom X w pierwszym pokoleniu przekażą córkom, natomiast osobnikom męskim zostanie on przekazany dopiero w pokoleniu F2 (przez samicę z pokolenia F1).
Jako, że gen determinujący badane przez nas cechy znajduje się właśnie na chromosomach płci to cecha warunkowana przez taki gen dziedziczy się inaczej w zależności od tego czy została wprowadzona do krzyżowania przez samca, czy samicę, więc kierunek krzyżowania ma znaczenie dla efektów fenotypowych w pokoleniu potomnym.
Geny znajdujące się na autosomach dają taki sam wynik krzyżówek, bez względu na kierunek krzyżowania ponieważ chromosomy te są takie same u obu płci, więc dla cech autosomalnych kierunek krzyżowania nie ma wpływu na efekt fenotypowy.
Literatura:
1.Lubosława Nowaczyk, Elwira Śliwińska, Wybrane zagadnienia z genetyki, 2001, Wydawnictwa Uczelniane Akademii Techniczno-Rolniczej w Bydgoszczy.
2.Maria Bogdzińska, Araszkiewicz Jadwiga, Podstawy genetyki zwierząt, Wydawnictwa Uczelniane Akademii Techniczno-Rolniczej w Bydgoszczy.
3.Gerard Drewa, Tomasz Ferenc, Podstawy genetyki dla studentów i lekarzy, 2003, Wydawnictwo Urban & Partner.
Wyszukiwarka
Podobne podstrony:
Sprawozdanie Mucha poprawione, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Genetyka
Pytania egzaminacyjne z Agrometeorologii, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Agromet
botanika ćwiczenia, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Botanika, bot
Nasiennictwo 2 kolo gotowa, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Nasiennictwo
+Ťci¦ůga 2 ko+éo z zestaw+-w 8 sztuk, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Nasiennictw
fizjologia roslin, Szkoła Rolnictwo studia, Szkoła, Materiały studia, fizjo roslin
Kolo biochemia KOMPLET NOTATEK AMINOKWASY, Szkoła Rolnictwo studia, Szkoła, Materiały studia, bioche
rolnictwo 1rok (9), Szkoła Rolnictwo studia, Szkoła, Materiały studia, materialy - biotechnologia
Gleba, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Gleboznastwo, gleba
glebik, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Gleboznastwo
Poprawka kola z oddychania ściąga1, Szkoła Rolnictwo studia, Szkoła, Materiały studia, fizjologia ro
Rodziny opis, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Botanika, bot
Ćw1rolnicy, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Gleboznastwo, Gleboznawstwo
fizjologia roslin, Szkoła Rolnictwo studia, Szkoła, Materiały studia, fizjo roslin
fizjologia roslin, Szkoła Rolnictwo studia, Szkoła, Materiały studia, fizjo roslin
fizjologia roslin, Szkoła Rolnictwo studia, Szkoła, Materiały studia, fizjo roslin
więcej podobnych podstron