Ćwiczenie nr 6. (2 godz.)
6. Podstawy elektrochemii i korozja.
Szereg napięciowy metali i potencjały elektrodowe.
Obliczenia elektrochemiczne: prawa Faradaya, siła elektromotoryczna ogniw.
Korozja elektrochemiczna.
Obliczenia wieloetapowe z udziałem kilku składników i trzech faz.
Elektrochemia
Ogniwa galwaniczne są układami, w których następuje zmiana energii chemicznej w energię elektryczną, którą można czerpać z ogniwa. Metal zanurzony w roztworze nosi nazwę elektrody, a elektroda i naczynie z roztworem nazywa się półogniwem.
Potencjał elektrody
Po zanurzeniu metalu w roztworze zawierającym jony tego metalu następuje wymiana tych jonów między metalem a roztworem. Ustala się równowaga reakcji:
![]()
gdzie:![]()
- metal, ![]()
- jony tego metalu w roztworze, ![]()
- ładunek jonów, ich wartościowość, ![]()
- ilość elektronów wymienionych w tym procesie. Metal uzyskuje ładunek jednego znaku a roztwór ładunek przeciwnego znaku. Na granicy faz: metal-roztwór powstaje wtedy różnica potencjałów elektrycznych zwana potencjałem elektrody ![]()
.
Potencjał zależy od rodzaju metalu i aktywności (stężenia) kationów tego metalu w roztworze. Zależność tę opisuje wzór Nernsta
![]()
gdzie: ![]()
-stała gazowa (8,3143 J·mol-1·K-1); ![]()
-temperatura w skali bezwzględnej (K); ![]()
- stała Faradaya (96500 C·mol-1); ![]()
- wartościowość (ładunek) jonów; ![]()
- aktywność molowa formy utlenionej metalu, czyli aktywność molowa metalu w roztworze jest równa ![]()
; ![]()
- aktywność molowa formy zredukowanej metalu, a więc ![]()
; ![]()
- potencjał elektrody; oraz ![]()
- potencjał normalny elektrody, będący wielkością stałą, charakterystyczną dla danej elektrody.
Dla roztworów rozcieńczonych zamiast wzoru Nernsta (powyżej), można stosować wzór przybliżony
![]()
gdzie ![]()
jest stężeniem molowym jonów w roztworze.
Podstawiając wartości stałych oraz zamieniając logarytmy naturalne na dziesiętne (mnożnik 2,303), dla temperatury 25 °C potencjał elektrody można zapisać wzorem:
![]()
Znając wartość potencjałów normalnych wszystkich metali można uporządkować je w kolejności od najniższej wartości potencjału do najwyższej (najbardziej dodatniej). Otrzymany szereg nosi nazwę szeregu napięciowego metali.
Szereg napięciowy metali
Metale leżące w szeregu przed wodorem mają ujemne wartości potencjałów normalnych, a leżące za wodorem maja dodatnie wartości potencjałów normalnych i nazywają się metalami szlachetnymi. Metale o ujemnej wartości potencjałów normalnych wypierają z roztworów kwasów wodór, a więc rozpuszczają się w kwasach z wydzieleniem wodoru.
Metal o mniejszej wartości potencjału normalnego (bardziej ujemnej) wypiera metal o większej wartości potencjału normalnego z roztworu jego jonów - czyli metale mniej szlachetne wypierają z roztworu bardziej szlachetne.
Przykład 6.1
Jaki potencjał będzie miała elektroda kadmowa zanurzona w 1·10-4 molowym roztworze CdSO4 w temperaturze 25 °C. Stopień dysocjacji ![]()
tej soli jest równy 1. potencjał normalny elektrody kadmowej ![]()
wynosi -0,763 V.
Na elektrodzie kadmowej zachodzi następujący proces elektrodowy
![]()
, a więc ![]()
. Ponieważ ![]()
, stężenie jonów Cd2+ jest równe stężeniu molowemu soli, czyli ![]()
, zatem
![]()
Przykład 6.2
Płytki niklowe zanurzono do wodnych roztworów: a) MgSO4; b) TiCl2; c) CuSO4; d) AgNO3; e) ZnCl2. Ułożyć równania odpowiednich reakcji lub zaznaczyć, że reakcja nie zachodzi.
W przypadku a), b) i e) reakcja nie zachodzi ponieważ nikiel jest metalem bardziej szlachetnym od magnezu, tytanu i cynku (patrz szereg napięciowy metali). Dla pozostałych:
c) ![]()
d) ![]()
Siła elektromotoryczna ogniwa
Różnicę potencjałów elektrod ogniwa otwartego (nie pracującego) nazywamy siłą elektromotoryczną (SEM).
![]()
przy czym od potencjału elektrody o wyższej wartości potencjału (bardziej dodatniej ![]()
) odejmujemy potencjał elektrody o niższej wartości potencjału (bardziej ujemnej ![]()
).
Znając wartości potencjałów normalnych elektrod metalicznych tworzących ogniwo można określić znaki elektrod, przewidzieć kierunek reakcji biegnącej w ogniwie oraz obliczyć wartość normalnej siły elektromotorycznej ogniwa, która jest równa różnicy normalnych potencjałów elektrod:
![]()
.
Połączenie dwóch półogniw przewodnikiem powoduje proces redukcji (przyjmowania elektronów) w półogniwie o wyższym potencjale normalnym i proces utleniania (oddawanie elektronów) w półogniwie o niższej wartości potencjału.
Zatem siłę elektromotoryczną ogniwa SEM ![]()
można obliczyć odejmując potencjał półogniwa, w którym zachodzi utlenianie, od potencjału półogniwa, w którym zachodzi redukcja.
Przykład 6.3
Podać wartość siły elektromotorycznej dla ogniwa zbudowanego z elektrody miedzianej i elektrody cynkowej (obie zanurzone w roztworach o jednakowych stężeniach zawierających odpowiednio dwuwartościowe jony miedzi i cynku), w temperaturze 25 °C. Podać schematyczny zapis tego ogniwa.
Dodatnia elektroda jest elektroda miedziana ![]()
, a elektroda ujemna jest elektroda cynkowa ![]()
. Jeżeli elektrody połączy się przewodnikiem metalicznym, to popłynie prąd elektryczny. Elektrony płyną w przewodniku od cynku do miedzi, a w obu półogniwach biegną reakcje elektrodowe ![]()
(utlenianie) oraz ![]()
(redukcja). Sumując te równania stronami otrzymuje się równanie procesu zachodzącego w ogniwie: ![]()
.
Normalna siła elektromotoryczna tego ogniwa wynosi w temperaturze 25 °C:
![]()
Schemat tego ogniwa przedstawia się następująco:
![]()
Elektroliza i prawa Faradaya
Całokształt zjawisk towarzyszących przepływowi prądu elektrycznego przez roztwory elektrolitów nazywa się procesem elektrolizy. Istota elektrolizy polega na tym, że podczas przepuszczania prądu przez roztwór elektrolitu (albo przez stopiony elektrolit) dodatnio naładowane jony przemieszczają się do katody, a ujemnie naładowane przenoszą się do anody. Po dotarciu do elektrody, jony podlegają odpowiednim procesom elektrodowym prowadzącym do rozładowania się jonów, a na elektrodach wydzielają się produkty elektrolizy.
Procesy elektrolizy podlegają prawom elektrolizy zwanym prawami Faradaya.
I prawo Faradaya mówi, że: masa substancji wydzielona na elektrodzie jest wprost proporcjonalna do ładunku elektrycznego (q), który przepłynął przez roztwór elektrolitu
![]()
Wyrażając ładunek elektryczny jako iloczyn natężenia prądu elektrycznego (I) i czasu jego przepływu (t) otrzymujemy
![]()
Współczynnik proporcjonalności (k) nazywa się równoważnikiem elektrochemicznym i jest równy masie substancji wydzielonej podczas przepływu 1 kulomba elektryczności (1 C), czyli podczas przepływu prądu o natężeniu 1 ampera w czasie 1 sekundy. Wymiar równoważnika elektrochemicznego wynosi: ![]()
.
II prawo Faradaya mówi, że: masy różnych substancji wydzielone na elektrodach przez jednakowe ładunki elektryczne są wprost proporcjonalne do mas ich równoważników ![]()
. Masę mola równoważników określa wyrażenie
![]()
gdzie: ![]()
- masa molowa substancji redukującej lub utleniającej się na elektrodach;
![]()
- oznacza liczbę elektronów biorących udział w procesie elektrodowym (wartościowość jonu).
II prawo Faradaya wyraża się:
![]()
Ponieważ zgodnie z I prawem Faradaya można zapisać dwie zależności ![]()
oraz ![]()
, a zatem
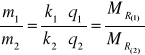
a gdy ![]()
, to
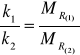
lub 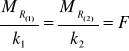
Stały, dla dowolnej substancji, stosunek masy mola równoważników do równoważnika elektrochemicznego ![]()
nazywa się stałą Faradaya.
F = 96500 C·(mol równoważników)-1 = 96500 A·s·(mol równoważników)-1
W celu wydzielenia z roztworu podczas elektrolizy 1 mola równoważników dowolnej substancji przepuszczamy przez roztwór ładunek 96500 kulombów.
Równoważnik elektrochemiczny można teraz zdefiniować wyrażeniem
![]()
gdzie: ![]()
- masa molowa elektrolizowanej substancji
![]()
- liczba elektronów biorących udział w procesie elektrodowym.
Dwa prawa Faradaya można wyrazić jednym wzorem
![]()
Wydajność prądowa elektrolizy ![]()
określa się jako stosunek ilości substancji otrzymanej praktycznie podczas elektrolizy ![]()
do ilości obliczonej teoretycznie na podstawie równania Faradaya ![]()
![]()
Przykład 6.4
Ile gramów miedzi wydzieli się na katodzie podczas elektrolizy wodnego roztworu CuSO4 w ciągu 5 minut, jeżeli natężenie prądu wynosi 10 amperów?
Reakcja elektrodowa biegnąca na katodzie: ![]()
Z prawa Faradaya mamy: ![]()
, czyli po zamienieniu minut na sekundy:
![]()
Korozja elektrochemiczna
Korozja elektrochemiczna jest procesem niszczenia metalu, związanym z przepływem prądu elektrycznego przez granice faz metal - roztwór elektrolitu, spowodowanym działaniem lokalnych ogniw galwanicznych. Na skutek, biegnącej w takim przypadku reakcji utleniania - redukcji anoda ulega rozpuszczeniu, a na katodzie wydziela się odpowiedni produkt redukcji. Proces anodowy i katodowy biegną w różnych miejscach powierzchni metalu.
Przyczyna powstawania makro- bądź mikroogniw korozyjnych może być np. połączenie dwóch różnych metali stykających się równocześnie z roztworem elektrolitu, obecność w metalu wtrąceń niemetalicznych, nierównomierny dostęp tlenu do powierzchni metalu, różnice stężeń elektrolitu w roztworze, w którym zanurzony jest metal, naprężenia mechaniczne w elemencie metalowym, częściowe pokrycie powierzchni metalu tlenkami, różnice temperatur różnych jej części. Czyli w skrócie, gdy zaistnieją okoliczności (takie jak powyżej) sprzyjające powstawaniu lokalnej różnicy potencjałów na powierzchni metalu, w miejscu tym dochodzi do przepływu prądu i zapoczątkowania procesu korozji elektrochemicznej.
Schemat mikroogniwa korozyjnego z kontaktującymi się różnymi metalami
Korozja żelaza w kropli roztworu elektrolitu w skutek różnego dostępu do niej powietrza
Zadania do samodzielnego rozwiązania:
Znając wartość potencjałów normalnych elektrody miedziowej
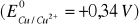
i niklowej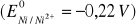
. Obliczyć wartość siły elektromotorycznej ogniwa o schemacie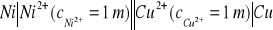
Z płytek: magnezowej i ołowianej zbudowano ogniwo zanurzając je do wodnych roztworów swych dwuwartościowych jonów o jednakowych stężeniach. Określić znaki obu elektrod, a następnie obliczyć wartość siły elektromotorycznej w warunkach standardowych oraz podać schemat tego ogniwa.
Z ilu połączonych szeregowo ogniw
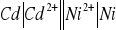
musi składać się bateria, aby jej siła elektromotoryczna była wyższa od 9 V?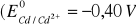
,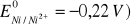
Obliczyć normalną siłę elektromotoryczna ogniw, w których biegną następujące reakcji:
a) ![]()
;
b) ![]()
.
Obliczyć potencjał elektrody kadmowej w temperaturze 25 °C zanurzonej w roztworze zawierającym
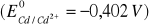
:1,00·10-2 mola CdSO4 w 1 dm3
1,00·10-3 mola CdSO4 w 1 dm3
5 g pewnego metalu wrzucono do roztworu soli srebrowej. Metal rozpuścił się tworząc jony dwudodatnie a wydzielone srebro po przemyciu i wysuszeniu ważyło 16,6 g. Obliczyć masę molowa tego metalu.
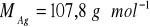
.Blaszkę kadmową o masie 50 g zanurzono do roztworu siarczanu miedzi(II) (CuSO4). Po wyjęciu stwierdzono, że sucha blaszka waży 44 g. Obliczyć, ile gramów miedzi przeszło z roztworu na blaszkę.
Do roztworu ZnCl2 zanurzono płytkę magnezową o masie 30,0 g. Po zakończeniu reakcji stwierdzono, że jej masa zwiększyła się o 3,7 g. Ile gramów magnezu i ile gramów cynku zawierała płytka po wyjęciu jej z roztworu, przemyciu i wysuszeniu?
Jak długo należy przepuszczać prąd o natężeniu 1,0 A przez roztwór azotanu srebra (AgNO3), aby wydzielić 100 mg srebra?
Elektrolizer zawiera 200 cm3 wodnego 0,5 molowego roztworu CuSO4. W roztworze tym zanurzono dwie elektrody platynowe i przeprowadzono elektrolizę przy stałym natężeniu prądu 0,5 A. Jak długo powinna trwać elektroliza, by całkowicie usunąć jony miedziowe z roztworu?
Poddano elektrolizie wodny roztwór kwasu solnego (HClaq) o stosunkowo dużym stężeniu. W momencie, kiedy objętość wydzielonego wodoru wynosiła 20 cm3, przerwano elektrolizę. Jaki produkt otrzymano na anodzie i jaka była jego objętość, jeżeli 5% tego gazu rozpuściło się w pozostałym roztworze?
Jaka była wydajność prądowa, jeżeli podczas elektrolizy prądem o natężeniu 2,60 A w ciągu 200 sekund osadzono 0,1 g metalicznej miedzi?
8
8
Wyszukiwarka
Podobne podstrony:
Cw 2, szkola, szkola, sem 3, MARCIN STUDIA, Chemia
W07 02, szkola, szkola, sem 3, MARCIN STUDIA, Budownictwo ogólne, Budownictwo Ogólne
0r1fi075teta25, szkola, szkola, sem 3, MARCIN STUDIA, Mechanika teoretyczna
2r2fi075teta045, szkola, szkola, sem 3, MARCIN STUDIA, Mechanika teoretyczna
3r2fi1teta045, szkola, szkola, sem 3, MARCIN STUDIA, Mechanika teoretyczna
Mat-w1, szkola, szkola, sem 3, MARCIN STUDIA, Materiały budowlane
PODSTAWY PRAWNE STOSOWANIA MATERIAŁÓW, szkola, szkola, sem 3, MARCIN STUDIA, MB
Mat-11, szkola, szkola, sem 3, MARCIN STUDIA, Materiały budowlane
1r2fi05teta045, szkola, szkola, sem 3, MARCIN STUDIA, Mechanika teoretyczna
W02, szkola, szkola, sem 3, MARCIN STUDIA, Budownictwo ogólne, Budownictwo Ogólne
Wyk1FXN, szkola, szkola, sem 3, MARCIN STUDIA, Fizyka budowli
W03, szkola, szkola, sem 3, MARCIN STUDIA, Budownictwo ogólne, Budownictwo Ogólne
W01, szkola, szkola, sem 3, MARCIN STUDIA, Budownictwo ogólne, Budownictwo Ogólne
W07 02, szkola, szkola, sem 3, MARCIN STUDIA, Budownictwo ogólne, Budownictwo Ogólne
elektra sem 7, aaa, studia 22.10.2014, Materiały od Piotra cukrownika, materialy Kamil, płytkas V, S
Pytania abcd z zeszłorocznego egzaminu z chemii, Szkoła Rolnictwo studia, Szkoła, Materiały studia,
cw 9, Szkoła Rolnictwo studia, Szkoła, Materiały studia, Gleboznastwo
więcej podobnych podstron