R2-R3
Czym się zajmuje termodynamika? Co różni termodynamikę klasyczną od termodynamiki statystycznej?
Jest to dział chemii zajmujący się badaniem przemian energii. W szczególności przeminą energii cieplnej w pracę i odwrotnie. Termodynamika klasyczna zajmuje się zagadnieniem w skali makroskopowej, natomiast termodynamika statyczna przechodzi do oddziaływać molekularnych.
Czym jest energia?
Jest zdolnością wykonywania pracy.
Co to jest perpetuum mobile? Jak brzmi prawo zachowania energii?
Perpetuum mobile to teoretyczna maszyna, która mogłaby poruszać się w nieskończoność nie tracąc energii. Energi nie można zniszczyć, ani stworzyć. Można zmienić tylko jej postać.
Wymienić i scharakteryzować układy
Układ otwarty- posiada możliwość wymiany materii i energii z otoczeniem.
Układ zamknięty- może wymieniać tylko energię, ale nie materię.
Układ izolowany- nie może wymieniać ani energii, ani materii z otoczeniem.
Napisać reakcję rozkładu termicznego węglanu wapnia. Jaki jest kierunek przepływu energii, gdy węglan jest zamknięty w cylindrze z tłokiem?
CaCO3(s) --> CaO(s )+ CO2(g) w temp. około 800 stopni
Układ przekazał energię do otoczenia, gdyż wydzielił się gaz, a tłok poniósł się do góry.
Podać przykład układu i otoczenia, w których nie zachodzi wymiana energii na sposób pracy, a jedynie na sposób ciepła.
Naczynie w którym zachodzi reakcja zobojętniania, zanurzone w wodzie z lodem. W trakcie procesu wydziela się ciepło do otoczenia, co obserwujemy, jako topnienie lodu, natomiast żadna praca nie została wykonana.
Co różni pracę od ciepła w ujęciu molekularnym?
Praca to energia, która powoduje uporządkowany ruch cząsteczek. (podniesienie całego tłoka )
Ciepło powoduje chaotyczne i nierównomierne ruchy cząsteczek.
Podać trzy uzupełnienia stwierdzeń:
-Układ wykonuje pracę maksymalną, gdy ciśnienie zewnętrzne jest równe ciśnieniu w układzie.
-Układ wykonuje pracę maksymalną, gdy znajduje się w stanie równowagi mechanicznej ze swym otoczeniem.
-Układ wykonuje pracę maksymalną, gdy zmienia się w sposób odwracalny
Podać wzór na pracę wykonaną przez układ (wzór ogólny).
Praca= droga x siła oporu
Wyprowadzić wzór na pracę maksymalną, jaka można uzyskać podczas izotermicznego rozprężania gazu doskonałego. (str. 62)
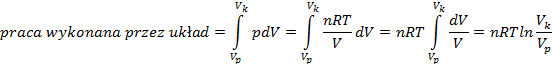
Czy poprawny jest zapis ΔU = 20kJ?
Nie, brakuje znaku (+,-)
Dlaczego w praktyce operujemy symbolem ΔU a nie symbolem U?
Nie jesteśmy w stanie określić rzeczywistej energii wewnętrznej układu, gdyż składają nie na niego różne rodzaje energii. Jesteśmy w stanie określić tylko zmianę tej energii. (Ilość zdjęć na świecie, jako przykład)
Uwzględniając przyjętą konwencję znakowania w termodynamice napisać wzór na izotermiczne odwracalne rozprężanie gazu doskonałego
![]()
Co to znaczy, że energia wewnętrzna jest funkcją stanu?
Oznacza to, że opisując ją istotna jest wartość (stan) jaką aktualnie przyjmuje, a nie droga po której doszło do uzyskania takiego stanu.
Podać treść (i wzór) pierwszej zasady termodynamiki
Energia wewnętrzna układu izolowanego jest stała.
ΔU=q
W jakich procesach ciepło jest funkcją stanu?
Izolowanych i izotermicznych
W jaki sposób kalibrujemy kalorymetr?
Do układu doprowadzamy znaną nam wartość ciepła (np. przepuszczamy prąd o znanym nam napięciu)i sprawdzamy, jak zmieni się temperatura. Znając ciepło i wzrost temp jesteśmy w stanie wyznaczyć, jaka ilość ciepła jest potrzebna do wzrostu temp. o 1 stopień.
Co to jest właściwa pojemność cieplna, co to jest molowa pojemność cieplna?
Właściwa pojemność cieplna jest przeliczana na masę próbki, natomiast molowa pojemność cieplna na ilość moli próbki.
Właściwa pojemność cieplna wody wynosi 1[cal/K.g]. Ile wynosi molowa pojemność cieplna wody w [J/K.mol]?
1cal=4,18J 1gH2O=1/18mola 1[cal/K*g]=4,18*18[J/K.mol]=75,24[J/K.mol]
Która z pojemności molowych gazów Doskonałych jest większa, pod stałym�ciśnieniem, czy w stałej objętości i dlaczego?
Przy stałym ciśnieniu. Dostarczając ciepło do takiego układu cześć energii jest wykorzystywana do rozprężenia gazu, co nie ma miejsca, gdy układ ma stałą objętość.
O ile zwiększy się energia wewnętrzna wody, gdy 1dm3 wody zostanie ogrzany o 10K? (przyjąć, że Cv = 75J/K.mol)
m=1000g n=1000/18= 55,56moli ΔT=10K
ΔU= 75*55,56*10=41,67kJ
O ile zwiększy się entalpia wody, gdy 1dm3 wody zostanie ogrzany o 10K? (Cp = 75J/K.mol)?
ΔH=n*Cp*ΔT ΔH=55,5*10*75=41,63kJ
Jakiemu typowi reakcji odpowiada zwiększenie entalpii układu?
Reakcji endotermicznej.
Jaki jest związek między entalpią a energią wewnętrzną układu?
H=U*pV oznacza to, że energia wewnętrza i entalpia, są funkcjami stanu.
Dlaczego entalpia wody w temperaturze wrzenia jest dużo większa niż entalpia metanu w temperaturze wrzenia?
Miedzy cząsteczkami wody występują wiązania wodorowe, które należy rozerwać, co wymaga większego nakładu energii.
Jak są ze sobą powiązane entalpie: parowania, topnienia i sublimacji? Podać wzór.
Entalpia sublimacji to entalpia sumująca entalpie topnienia i parowania ( entalpia jest funkcją stanu ). ΔsublH=ΔtopH+ΔparH
Dlaczego druga entalpia jonizacji jest większa od pierwszej entalpii jonizacji? Czy entalpie jonizacji są dodatnie, czy ujemne?
Oderwanie ładunku ujemnego (elektronu) od cząstki dodatniej ( kationu) jest trudniejsze ( wymaga więcej energii), niż oderwanie od cząstki obojętnej. Są ujemne.
Przyłączanie elektronu jest procesem egzo- czy endotermicznym?
Egzotermicznym i endotermicznym
Dlaczego w obliczeniach entalpii wiązań korzystamy ze średnich entalpii wiązań?
Jest to praktyczniejsze. Różnica entalpi w wiązaniach konkretnych cząstek, jest niewielka w porównaniu z wartościami uśrednionymi dla pierwiastków.
Od czego zależy liczbowa wartość entalpii reakcji?
Warunków przebiegu reakcji : stężeń reagentów, temperatury i ciśnienia.
Jak się definiuje stan standardowy substancji?
To czysta substancja, pod ciśnieniem 1 bar.
Standardowe entalpie spalania izooktanu i metanu wynoszą odpowiednio: -5461[kJ/mol]
i -890[kJ/mol]. Biorąc pod uwagę masę paliwa, które paliwo opłaca się bardziej magazynować?
Masa molowa metanu jest znacznie mniejsza od izooktanu. Dzieląc St. Entalpie przez masę molową otrzymamy, entalpie właściwą. (metan)
Jak brzmi prawo Hessa i do jakich celów jest używane?
Standardowa entalpia reakcji, jest równa sumie standardowych entalpi reakcji, na które można dana reakcję rozłożyć. Jest używane do obliczeń entalpi reakcji, w których występują związki nie występujące w tabelach.
Obliczyć standardową entalpię reakcji uwodorniania benzenu do cykloheksanu. Standardowe entalpie spalania benzenu, cykloheksanu i wodoru wynoszą odpowiednio; -3270[kJ/mol]
-3900[kJ/mol] i -286[kJ/mol].
C6H6 + 3H2 C6H12 ΔHo=?
C6H6 +7,5 O2 3 H2O +6 CO2 ΔHsp=-3270[kJ/mol]
C6H12 + 9O2 6H2O + 6CO2 ΔHsp=-3900[kj/mol]
H2 +2 O2 2 H2O ΔHsp=-286[kJ/mol]
C6H6 +7,5 O2 3 H2O +6 CO2 ΔHsp=-3270[kJ/mol]
6H2O + 6CO2 C6H12 + 9O2 ΔH=+3900[kj/mol] SUMA RÓWNAŃ
H2 +0,5 O2 H2O ΔHsp=-286[kJ/mol] /x3
C6H6 + 3H2 C6H12 ΔHo= (-3270)+3900+(3 .(-286))= - 228kJ
Mając dwa równania termochemiczne:
(1) C3H6(g) + H2(g) = C3H8(g) ΔH1θ = -124 kJ
(2) C3H8(g) + 5O2 = 3CO2(g) + 4H2O(c) ΔH2θ = -2220 kJ
obliczyć standardową entalpię reakcji spalania propenu, wiedząc, że standardowa entalpia spalania wodoru wynosi ΔHθ = -286 [kJ/mol].
Mamy 3 reakcje:
i (2) j.w.
H2 + 0.5O2=H2O ΔHθ = -286 [kJ/mol]
Celem jest otrzymanie reakcji spalania propenu : C3H6 +4.5 O2= 3CO2 + 3H2O
Dodając stronami (1)+(2) otrzymujemy:
C3H6(g) + H2(g) + 5O2= 3CO2(g) + 4H2O(c)
Od powstałej reakcji odejmujemy stronami (3), otrzymujemy:
C3H6 +4.5 O2= 3CO2 + 3H2O
Otrzymaliśmy reakcję spalania propenu. Aby obliczyć entalpie dodajemy (1)+(2)-(3)
ΔspHθ =ΔH1θ+ΔH2θ-ΔHθ więc ΔspHθ = -124+(-2220)-(-286)= - 2058kJ
Jak się definiuje standardową entalpię tworzenia substancji?
ΔtwHθ substancja przedstawia standardową entalpię reakcji, w której jeden mol powstaje z pierwiastków w ich stanach podstawowych.
Co rozumiemy pod pojęciem stan podstawowy pierwiastka?
Jest to najtrwalsza odmiana w danych warunkach.
Co to jest standardowa entalpia reakcji? Podać ogólny wzór na standardową entalpię reakcji.
ΔrHθ , jest równa sumie standardowych entalpi tworzenia wszystkich reagentów pomnożonych przez ich współczynniki stechiometryczne ( dla substratów -, dla produktów+)
ΔrHθ=ƩnΔtwHθ(produktów)- ƩnΔtwHθ(substratów)
O czym mówi prawo Kirchhoffa? Podać wzór.
Znając standarową entalpię reakcji w jednej temp. możemy obliczyć entalpię w innej.
ΔrHθ`= ΔrHθ+ΔrCp*ΔT gdzie ΔrCp= ƩnCp,m(produktów)- ƩnΔCp.m(substratów)
Podać dwa warunki, które muszą być spełnione, aby prawo Kirchhoffa było słuszne.
Nie może dojść do przemiany fazowej.
Pojemności cieplne są stałe ( niewielka różnica temp.)
Wymienić dwa podstawowe rodzaje procesów samorzutnych.
Chaotyczne rozpraszanie energii
Chaotyczne rozpraszanie materii
Jak brzmi druga zasada termodynamiki?
Entropia wszechświata ma tendencję do zwiększania się.
Podać definicję entropii.
Jest to miara nieuporządkowania materii i energii.
Dlaczego w definicji entropii występuje wartość ciepła, a nie pracy?
Ciepło wywołuje chaotyczny ruch, a praca uporządkowany. Entropia jest miarą nieuporządkowania, więc nie może odnosić się do pracy.
Z jaką cechą entropii związane jest „kichnięcie”?
Z zależnością dostarczonego ciepła od temperatury, która już panuje w układzie (określa obecny stan nieporządku).
Jaka jest zmiana entropii (w dowolnej temperaturze) 1 mola gazu doskonałego, gdy podwaja swoją objętość?
Dane: vp=22,4dm3 ; vk=44,8dm3 ; n=1mol
∆S=nRln(vk/vp)=5,8[J/K*mol]
Wykazać, że ΔS = CvlnTk/Tp.
![]()
Jeżeli:
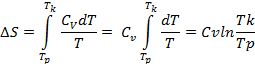
To:
Brom wrze w temperaturze 59°C. Jaka jest entalpia parowania ciekłego bromu?
ΔparH ≈ Tw . (85 J . K-1 . mol-1)
ΔparHbrom=332,4K . 85 J . K-1 . mol-1= +28kJ . mol-1
O czym mówi reguła Troutona? Podać wzór.
ΔparH/Tw ≈ +85 J . K-1 . mol-1
Podaje zależność entalpi parowania od temperatury wrzenia.
Przedstawić na rysunku sposób obliczenia entropii absolutnej.
Cv/T
T0 Temperatura,T
Entropia absolutna w temperaturze T = pole pod wykresem
Jak brzmi trzecia zasada termodynamiki?
Entropia każdej substancji tworzącej kryształ doskonały jest równa zeru dla T=0
Dlaczego standardowa entropia molowa diamentu jest mniejsza niż standardowa entropia molowa grafitu?
Odp. Ponieważ atomy w sieci grafitu są związane w sieć mniej sztywną niż atomy w sieci diamentu i większy jest nieporządek cieplny
Przyporządkować podane wielkości standardowych entropii molowych: 45[J/K.mol], 79[J/K.mol], 189[J/K.mol] dla trzech różnych stanów skupienia H2O.
189[J/mol∙K]-para wodna ; 79[J/mol∙K]-ciecz; 45[J/mol∙K]-lód
Jaka wielkość decyduje o samorzutności procesu?
całkowita zmiana entropii- układu i otoczenia razem wziętych.
Ile wynosi zmiana entropii otoczenia, gdy w procesie izotermiczno-izobarycznym entalpia reakcji wynosi ΔrHθ?
∆rSƟ= - ΔrHθ/T , gdy T=const, p=const
Mały gad wytwarza 0.50W ciepła. O jaką wartość zwiększa on w ciągu doby entropię otoczenia- jeziora o temperaturze 15°C?
Rozwiązanie:
Dane: Q=0,50[W=J/s] ; t=24h=86400[s ]; T=273+15=288K
Szukane: ∆Sot. =?
Obliczamy ciepło dostarczane otoczeniu przez gada w ciągu doby, a następnie zmianę entropii otoczenia
q= Q∙ t=0,50[J/s] ∙86400[s] = 43200 [J]
∆Sot. = q / T = 43200[J] /288[K] =150 [J/K]
Podać wzór wiążący całkowitą zmianę entropii układu i otoczenia z wielkościami odnoszącymi się tylko do układu.
Podać definicję entalpii swobodnej.
Entalpia swobodna inaczej energia swobodna Gibssa
Uzupełnij zdanie: ”W warunkach stałej temperatury i ciśnienia zmiana entalpii swobodnej układu jest wprost proporcjonalna...”.
do całkowitej zmiany entropii układu wraz z jego otoczeniem.
Podać dwie podstawowe właściwości entalpii swobodnej.
1) W warunkach izotermiczno-izobarycznych samorzutnego procesu entalpia swobodna układu maleje
2)Wartość zmiany entalpii swobodnej określa maksymalną pracę nie objętościową jaką może dostarczyć układ w którym przebiega proces izotermiczno- izobaryczny.
Czemu jest równa standardowa entalpia swobodna reakcji?
jest równa różnicy sumy standardowych molowych entalpii swobodnych produktów i substratów pomnożonych przez współczynniki stechiometryczne każdego produktu i każdego substratu.
Jak praktycznie oblicza się standardową entalpię swobodną reakcji?
Standardową entalpię swobodną reakcji oblicza się praktycznie ze standardowych entalpii i entropii reakcji , które bierzemy z tablic , wg zależności:
Przedstawić tabelę obrazującą, jak wielkości entalpii i entropii wpływają na kierunek procesu, czy jest on samorzutny, czy też nie jest?
Entalpia |
Entropia |
Samorzutny? |
∆H < 0 egzotermiczny |
∆S > 0 |
Tak (∆G <0) |
∆H < 0 egzotermiczny |
∆S < 0 |
Tak jeżeli |
∆H > 0 endotermiczny |
∆S > 0 |
Tak jeżeli T ∙ ∆S > ∆H |
∆H > 0 endotermiczny |
∆S < 0 |
Nie (∆G > 0) |
Czemu równa się standardowa entalpia swobodna reakcji: 2CO(g) + O2(g) = 2CO2(g) ?
=2∙
Dlaczego benzen nie ulega rozkładowi na pierwiastki, mimo że standardowa entalpia swobodna tej reakcji rozkładu wynosi +134[kJ/mol]?
Ponieważ benzen jest termodynamicznie nietrwały niestabilny w stosunku do pierwiastków i wykazuje tendencję do samorzutnego rozpadu na pierwiastki, ale samorzutność tego procesu jest bardzo wolna i nie zachodzi zauważalnie. Dlatego też benzen może stać w laboratorium na półce i nie grozi mu szybki rozkład.
Jaka jest różnica między standardową entalpią swobodną reakcji i entalpią swobodną reakcji? (Podać opis słowny)
Standardowa swobodna entalpia reakcji
przedstawia zmianę entalpii swobodnej wywołanej przebiegiem reakcji, gdy czyste substraty dają czyste produkty, a wszystkie reagenty występują w stanie standardowym;
Entalpia swobodna reakcji
przedstawia zmianę entalpii swobodnej wywołanej przebiegiem reakcji, gdy reakcja zachodzi w mieszaninie reagentów o określonym składzie.
Podać warunek, przy którym układ jest w stanie równowagi.
Układ jest wstanie równowagi, gdy entalpia swobodna reakcji jest równa zero.
Za pomocą ciśnień parcjalnych wyrazić iloraz reakcji i stałą równowagi reakcji syntezy amoniaku.
N2 (g) + 3H2 (g) → 2NH3
Jak definiuje się aktywności dla gazów doskonałych, dla czystych ciał stałych i cieczy, dla rozcieńczonych roztworów?
dla gazów doskonałych:
dla ciał stałych i cieczy:
;
dla rozcieńczonych roztworów:
gdzie aJ-aktywność substancji J ; pJ-ciśnienie ; [ J ]- stężenie molowe roztworu substancji J
Wychodząc z zależności dG = dH - TdS wykazać, że Gm = Gmθ = RT ln p/pθ.
Nasza zależność:
Wiemy że:H= U+ p∙V, zatem zmianę H można wyrazić przez zmianę U,p,V
Ponieważ:
To:
dq+ dw+ pdV + Vdp = TdS+ (-pdV) + pdV+ Vdp
Gdy zredukuję wyrazy podobne to:
Podstawiam do naszej zależności:
Gdy zredukuję wyrazy podobne:
Jeśli układ jest nieściśliwy tzn. V jest niezależne od p to całką oznaczoną z powyższego wyrażenia jest (dla cieczy i ciał stałych):
Dla gazu gdzie V jest zależne od p, ciśnienie zmienia się z ppdo pk ,a V=nRT/p
Jeżeli pp=pɵ(przy tym ciśnieniu G=Gɵ), pk=p( wówczas entalpia swobodna ma wartość G) to wtedy ∆G=G - Gɵ
To wtedy
Dzielimy stronami przez n i otrzymujemy wzór swobodnej entalpii molowejgazu doskonałego:
Gdy uwzględnimy warunki standardowe czyli pɵ=1 bar, p/pɵ=a, dla ciśnienia 1bar a=1 to wtedy:
Czyli dla warunków standardowych i dla gazu doskonałego
Podać równanie, które pozwala przewidywać wartość stałej równowagi na podstawie tablic wartości funkcji termodynamicznych.
Jaki jest wpływ temperatury na wartość stałej równowagi? Wyprowadzić równanie van't Hoffa.
Wiemy że:
Wstawiając wzór z punktu 72 otrzymamy:
Dzieląc stronami przez -RT otrzymamy dla T :
Dla T' :
To:
To:
Stała równowagi reakcji endotermicznej zwiększa się, gdy podwyższa się temperaturę.
Jak Haber zwiększył stężenie amoniaku w mieszaninie reakcyjnej, mimo małej wartości stałej równowagi reakcji syntezy amoniaku z wodoru i azotu?
Ponieważ do syntezy amoniaku jest potrzebna wysoka temperatura a to zmniejszało wartość K dlatego Haber prowadził syntezę amoniaku pod bardzo wysokim ciśnieniem co spowodowało zwiększenie stężenia amoniaku.
Wyszukiwarka
Podobne podstrony:
Pytania6-7, Chemia pwr, Pytania z chem fiz niestacjonarne
Egzamin - chemia fizyczna (2), Egzamin chem.fiz
Chem. Fiz. II rok pytania, studia - analityka chemiczna UMCS, III semestr, chemia fizyczna
chem.fiz.równowagi fazowe, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chemia fizyczna laboratoria, iwona chem. fiz. ćw. 91
lab chem fiz 23, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Chemia fizyczna cd (2), Egzamin chem.fiz
chem.fiz.stała dysocjacji, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laboratorium
chem fiz, Studia, Chemia, fizyczna, examin
PYTANIA FIZJO EGZAMIN-seminarki gr.3, II ROK STOMATOLOGIA SUM ZABRZE, FIZJOLOGIA, FIZJOLOGIA EGZAMIN
lab chem fiz 34, BIOTECHNOLOGIA POLITECHNIKA ŁÓDZKA, CHEMIA FIZYCZNA
Chem fiz egz grupa A, Studia, Chemia fizyczna, Od Anki, egzaminy
raport chem fiz 4, II rok od 4 piętro;), CHEMIA FIZYCZNA
chem.fiz.współ.podziału Nernsta, Inżynieria środowiska, inż, Semestr III, Chemia fizyczna, laborator
więcej podobnych podstron