![]()
w poprzednim odcinku:
teoria Brönsteda-Lowry'ego - definiuje kwas jako donor protonów, a zasadę jako akceptor protonów w reakcjach proteolitycznych;
stała dysocjacji (K) i iloczyn rozpuszczalności (Ir) są wielkościami równowagowymi i jako takie dla danych reagentów zależą wyłącznie od temperatury;
inne czynniki (poza temperaturą) jedynie zaburzają równowagę, a nowy stan równowagi osiągany jest zgodnie z regułą przekory, w taki sposób, że można go opisać takimi samymi wartościami K i Ir, jak przed zaburzeniem stanu równowagi;
CHEMIA 3
SKALA pH
![]()
w czystej wodzie ![]()
![]()
pH = 7 |
roztwór obojętny |
pH > 7 |
roztwór zasadowy |
pH < 7 |
roztwór kwaśny |
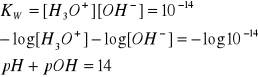
SKALA pH JEST SKALĄ LOGARYTMICZNĄ:
zmiana wartości pH o 1 odpowiada 10-krotnej zmianie stężenia jonów hydroniowych;
zmiana wartości pH o 0,3 odpowiada 2-krotnej zmianie stężenia jonów hydroniowych;
skala pH w zakresie od 0 do 14 dla roztworów wodnych odnosi się do roztworów rozcieńczonych;
postać logarytmiczna Kd
![]()
pKA kwasu węglowego:
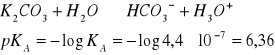
pKA wodorowęglanu
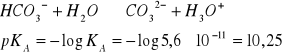
OBLICZANIE pH ROZTWORÓW MOCNYCH KWASÓW I ZASAD
mocne kwasy
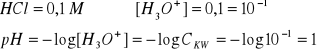
mocne wodorotlenki
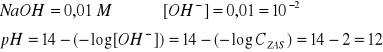
MIARECZKOWANIE MOCNEGO KWASU
miareczkowanie kwasu - wprowadzanie niewielkich porcji odczynnika zobojętniającego badany kwas, np. ![]()
HCl miareczkujemy NaOH:
OBLICZANIE pH ROZTWORU SŁABYCH KWASÓW I ZASAD:
dysocjacja słabego kwasu
![]()
![]()
![]()
![]()
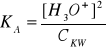
![]()
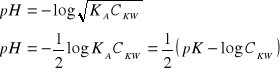
MIARECZKOWANIE SŁABEGO KWASU:
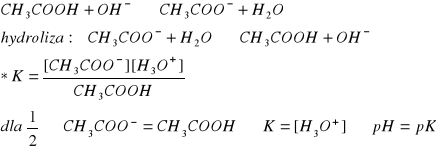
Który roztwór ma większe pH:
0,01 M HCl
0,01 M CH3COOH
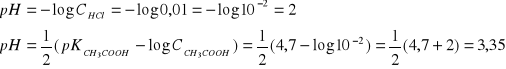
ROZTWORY BUFOROWE:
struktura i funkcja białka zalezy od pH;
jest to mieszanina słabego kwasu i sprzężonej z nim zasady w postaci soli tego kwasu lub mieszanina słabej zasady i sprzężonego z nią kwasu w postaci soli tej zasady;
posiada zdolność do utrzymania stałego pH po wprowadzeniu niewielkich ilości mocnego kwasu lub zasady;
przykłady:
bufory kwasowe: ![]()
![]()
![]()
bufor zasadowy: ![]()
![]()
![]()
pH ROZTWORU BUFOROWEGO:
buforem jest roztwór wodny, będący mieszaniną kwasu octowego i jego soli octanu sodu, który dysocjując daje sprzężoną z kwasem octowym zasadę, czyli jon octanowy;
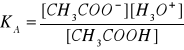
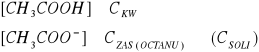

![]()
pH roztworu buforowego:
![]()
← równanie Hendersona-Harselbalcha
wartość pH nie zależy od stężeń składników, ale od stosunku tych stężeń;
zakres działania buforu jest uwarunkowany rodzajem składników tworzących ten bufor i zależy od wartości pH (słabego kwasu lub zasady);
jeżeli stosunek stężeń ![]()
zmieni się z 1:1 do 10:1 lub 1:10, to zmiana pH = 1;
rozcieńczenie wodą nie powinno zmieniać wartości pH buforu, gdyż zależy ona od stosunku stężeń obu składników, które rozcieńczają się identycznie;
POJEMNOŚĆ BUFOROWA:
![]()
dodanie do roztworu buforowego niewielkich ilości mocnego kwasu lub mocne zasady zmienia stężenia składników, ale stosunek stężeń zmienia się nieznacznie i dlatego pH buforu zmienia się nieznacznie;
![]()
pojemność buforowa - zdolność do utrzymywania stałego pH przez wiązanie jonów H3O+ i OH-; zależy od:
stężenia obu składników (stężenia buforu);
stosunku stężeń składników buforu;
![]()
(liczba moli jednoprotonowego mocnego kwasu lub liczba moli jonów wodorotlenkowych, jaką należy wprowadzić do 1dm3 roztworu buforowego, aby zmienić jego pH o jednostkę)
MIARECZKOWANIE KWASU WĘGLOWEGO:
* obszary buforowania
![]()
![]()
BUFOR H2PO4- / HPO42- (działa w komórkach):
istnieją 3 układy buforowe (jakie?);
![]()
BIOLOGICZNIE WAŻNE BUFORY:
za równowagę kwasowo-zasadową osocza krwi odpowiedzialne są:
bufory wodorowęglanowe H2CO3 / HCO3-
bufory białczanowe H-białczan / białczan-
bufory wodorofosforanowe H2PO4- / HPO42-
prawidłowa wartość pH krwi = 7,4;
bufory wodorowęglanowe działają w osoczu w układzie otwartym (płuca, nerki, tkanki) stąd jego pojemność buforowa jest kilkakrotnie większa, niż byłaby w układzie zamkniętym;
ODDECHOWA REGULACJA RÓWNOWAGI KWASOWO-ZASADOWEJ:
bufor wodorowęglanowy jest istotnym elementem regulacji pH płynów pozakomórkowych;
w osoczu występuje: ![]()
99% 1% 0,7%
równowagę określa stała dysocjacji 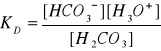
;
stąd pH roztworu 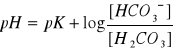
;
kwas węglowy stanowi tylko małą część rozpuszczonego dwutlenku węgla, stąd:
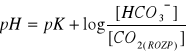
;
H2CO3 i CO2(ROZP) pozostają w równowadze z CO2 w fazie gazowej CO2 w krwi przepływającej przez płuca pozostaje w równowadze z CO2 powietrza w pęcherzykach płucnych (z prawa Henry'ego, ilość gazu (M) rozpuszczona w cieczy jest wprost proporcjonalna do ciśnienia parcjalnego (p) gazu nad cieczą: ![]()
(stężenie gazu rozpuszczonego w cieczy)
M - masa mola gazu
V - objętość
α - współczynnik rozpuszczalności
* stężenie CO2 rozpuszczonego w osoczu ![]()
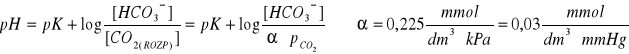
w warunkach fizjologicznych ![]()
w pęcherzykach, stąd:
![]()
![]()
we krwi prawidłowej oraz ![]()
H3O+ produkowany w metabolizmie tkankowym, cofa dysocjację kwasu węglowego, przyłączając się do HCO3-, kwas węglowy rozpada się na H2O i CO2, który jest wydalany przez płuca;
komórka mięśniowa |
naczynia włosowate |
H3O+ CO2 |
H3O+ + HCO3-
H2CO3
H2O + CO2 |
produkcja dwutlenku wegla oraz jonów hydroniowych w tkankach nie zmienia stałego stosunku: 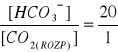
a więc i pH płynów ustrojowych, gdyż nadmiar CO2 jest wypadalny w płucach (układ otwarty);
przy zmienionym stosunku następuje przyspieszenie i pogłębienie oddechu, co zwiększa wentylację płuc, usuwa nadmiar CO2 do momentu przywrócenia stosunku 20:1;
DYFUZJA, OSMOZA, CIŚNIENIE OSMOTYCZNE:
DYFUZJA - proces samorzutnego, biernego przemieszczania się cząsteczek z przestrzeni o większym stężeniu do przestrzeni o mniejszym stężeniu, aż do osiągnięcia stanu równowagi dynamicznej;
szybkość dyfuzji zależy od:
temperatury (wzrasta wraz z nią);
gradientem stężeń (dla fazy ciekłej) lub ciśnień (dla fazy gazowej);
wymiarów cząsteczek;
na dyfuzji opiera się wymiana gazowa w płucach (między gazami w pęcherzykach i krwią w naczyniach włosowatych);
dyfuzja jest także chaotycznym ruchem cząsteczek w komórce;
małe cząsteczki dyfundują przez uwodniony żel cytozolu niemal tak szybko, jak w wodzie;
szybka dyfuzja zwiększa prawdopodobieństwo efektywnego zderzenia cząsteczek substratów z aktywnym centrum enzymu;
OSMOZA - samorzutne przechodzenie cząsteczek rozpuszczalnika przez błonę półprzepuszczalną (przepuszczalną tylko dla cząsteczek rozpuszczalnika);
odbywa się w kierunku roztworu i niższym stężeniu rozpuszczalnika (wyższe stężenie substratów rozpuszczonych), aż do osiągnięcia stanu równowagi;
warunkiem koniecznym do wystąpienia osmozy jest równa liczba cząsteczek osmotycznie czynnych po obu stronach błony półprzepuszczalnej;
CIŚNIENIE OSMOTYCZNE - ciśnienie, w którym ustala się równowaga dynamiczna, czyli gdy jednakowe ilości cząsteczek rozpuszczalnika dyfundują w obu kierunkach;
równowaga zostaje osiągnięta, gdy po obu stronach błony znajdują się roztwory o jednakowej liczbie cząsteczek osmotycznie czynnych;
Chemia medyczna - wykład trzeci
1