Chemia Krzemianów
Rozpowszechnienie pierwiastków w skorupie ziemskiej:
Tlen-46,60%
Krzem-27,72%
Glin-8,13%
Wapń-3,63%
Sód-2,83%
Potas-2,83%
Magnez-2,09%
Wodór-0,14%
Fosfor-0,12%
Fluor-0,08%
Węgiel-0,03%
Pozostałe-6,04%
Rozpowszechnienie minerałów:
Plagioklazy-39%
Skalenie alkaliczne-12%
Kwarc-12%
Pirokseny-11%
Amfibole-5%
Miki-5%
Ilaste-5%
Inne krzemiany-3%
Inne-8%
Pierwiastek krzem.
Atom krzemu ulega hybrydyzacji sp3 i występuje najczęściej na IV stopniu utlenienia, czasem orbital 3s2 nie jest aktywny i w takim wypadku krzem występuje na II stopniu utlenienia (SiO, SiS, SiF2). Czysty krzem rzadko występuje w przyrodzie jako samodzielny pierwiastek jednak jego pierwiastkowa postać na zastosowanie w elektrotechnice(redukcja SiO2, na który działabym HCl w wys.temp., powstaje SiHCl3, który oczyszczamy destylacją frakcjonowaną, ulega rozkładowi w wys.temp.).
Podstawowe właściwości fizykochemiczne krzemu:
- Masa atomowa: 28,0855
- Konf.elektr(znasz, l.at. 14)
- Promień atomowy: 1,06 Å
- promień jonowy(Si4+ ): 0,26 Å (LK4); 0,41 Å (LK6)
- elektroujemność: 1,9(Pauling); 1,74(Allred); 1,82(Gorlich)
- gęstość: 2,33 g/cm3
- objętość molowa: 12,06cm3
-twardość: 6,5(w skali Mohsa).
Krzem w normalnych warunkach ma strukturę podobną do diamentu, o symetrii Fd3m, która jest komórką płasko centrowaną, każdy atom krzemu ma liczbę koordynacyjną 4. Pod wysokim (ale nie bardzo wysokim) ciśnieniem krzem tworzy strukturę heksagonalną o symetrii P63mc. Gdy zredukujemy SiO2 metalicznym magnezem otrzymujemy krzem jako brunatny proszek, który określamy jako krzem bezpostaciowy. Kryształy krzemu ma kształt ośmiościanów o połysku metalicznym.
Krzem jest półprzewodnikiem dzięki czemu ma ogromne zastosowanie we współczesnej elektrotechnice (technika mikroprocesorowa); jego przewodnictwo może być stymulowane poprzez wprowadzanie domieszek. Krzem jest nieaktywny chemicznie, ponieważ ulega pasywacji; bardzo rozdrobniony spala się w powietrzu po ogrzaniu, we fluorze spala się w temp.pokojowej; nie reaguje z kwasami ale reaguje z zasadami.
Chemia krzemu a chemia węgla.
Podobna struktura elektronowa, jednak pierwiastki te posiadają zupełnie różne chemie.
Różnice:
-jedna więcej powłoka elektronowa krzemu(krzem jest bardziej elektrododatni od węgla; w wiązaniu z wodorem atom krzemu polaryzuje dodatnio a węgiel ujemnie; różnica w powłokach wpływa na różnicę w wielkości promienia atomowego i jonowego);
-węgiel chętniej tworzy wiązania podwójne z orbitalem typu π; krzem posiada natomiast pusty orbital d; krzem tworzy najsilniejsze wiązania z tlenem i chlorowcami, węgiel z wodorem, chlorowcami i drugim atomem węgla; najsłabsze wiązanie krzemu to z drugim atomem krzemu;
-związki węgla są najczęściej cieczami lub kryształami w postaci molekuł, które topią się w niskich temp., rzadko ulegające hydrolizie, w wys.tem. spalają się do CO2 w obecności tlenu; związki krzemu najczęściej to ciała stałe posiadające budowę amorficzna lub krystaliczną oraz wiązanie jonowo-kowalencyjne, niepalne, topiące się w wysokich temp.
Preferowane rodzaje wiązań chemicznych
Przez węgiel |
Przez krzem |
Mostki -C-C-C- |
Mostki -Si-O-Si-O- |
Nietrwałe długie łańcuchy -C-O-C-O-C- |
Nietrwałe długie łańcuchy -Si-Si-Si- |
Pierścienie węglowe, najczęściej 6-krotne |
Pierścienie krzemo tlenowe, najczęściej 6-krotne |
Wiązanie kowalencyjne (małospolaryzowane)pojedyncze typu σ |
Wiązanie spolaryzowane jonowo-kowalencyjne |
Wiązanie podwójne i potrójne z udziałem orbitali typu π |
Udział pustego orbitalu 3d krzemu w wiązaniu Si-O |
Wiązanie C-σ - H+σ trwałe i niepodatne na hydrolizę |
Wiązanie Si+σ-H-σ nietrwałe i silnie podatne na hydrolizę |
Podobieństwa:
-struktura oparta na prostych, rozgałęzionych lub pierścieniowych sekwencjach;
-dążenie do tetraedrycznego układu najbliższych sąsiadów;
-zdolność do tworzenia polimerów;
-zmiana warunków zewnętrznych wpływa na samorzutne przemiany związków;
-naturalne występowanie bardzo licznej grupy związków tych dwóch pierwiastków;
-praktyczne zastosowanie w technice i technologii.
Związki krzemu.
Z metalami krzem będzie zawsze elektroujemny a z niemetalami elektrododatni (oraz wodoru). Krzemiany-nieorganiczne ciała stałe; Siloksany - kryształy molekularne.
Dwuskładnikowe związki krzemu z metalami.
Stechiometria zupełnie nie pasuje do wartościowości pierwiastków więc bardzo ciężko zdefiniować te związki. Posiadają również trudne do określenia wiązania chemiczne, które nie zawsze mają charakter metaliczny. Krzem może tutaj występować w postaci grup np. Si2, Si4. Mogą występować różnie wiązania obok siebie w jednej strukturze (od kowalencyjnych, przez jonowe aż po metaliczne). W strukturach krzemków Si może występować w formie pojedynczych atomów, w innych może tworzyć pofałdowane warstwy lub szkielety. Krzemki metali mają strukturę krystaliczną, z reguły są twarde i topią się w wysokich temperaturach. Otrzymywane są jako cienkie powłoki na krzemie. Zastosowanie: elementy w urządzeniach elektronicznych, fotodetektory, elementy grzejne, odtleniacze stali.
Dwuskładnikowe związki krzemu z niemetalami.
Krzem w związkach z niemetalami jest zawsze elektrododatni (stąd nazwa np. węglik krzemu a nie np. krzemek węgla). Wiązanie ma charakter kowalencyjny w małym stopniu spolaryzowany.
Węglik krzemu (SiC).
Posiada formę krystaliczną o wysokiej twardości (9,7 w sk. Mohsa); czyste kryształy są bezbarwne jednak najczęściej kryształki SiC posiadają zanieczyszczenia i jest ciemnoszary; techniczny węglik krzemu nazywany jest karborundem. Struktura podobna do diamentu (co drugi atom węgla został podstawiony krzemem); posiada dwie odmiany krystalograficzne: α-SiC(sfaleryt, heksagonalny, wysokotemperaturowy) i β-SiC(wurcyt, regularny, niskotemperaturowy). Wiązanie chemiczne w SiC jest kowalencyjne i bardzo silne (przez co ma właściwości zbliżone do diamentu). Jest odporny chemicznie, nie ulega działaniu kwasów organicznych, HF, jest odporny na utlenianie. SiC otrzymuje się w piecach elektrycznych z koksu i piasku kwarcowego (gdy otrzymano go pierwszy raz sądzono, że jest to mieszanina węgla i korundu, stąd wzięła się jego nazwa karborund). Stosowany jest jako materiał ścierny, materiał ogniotrwały (posiada bardzo wysoką temp.topnienia), jest półprzewodnikiem dzięki czemu ma zastosowanie w piecach elektrycznych jako elementy grzewcze, nowoczesna ceramika specjalna, elementy optyczne i mikroelektryczne.
Azotek krzemu(Si3N4).
Tworzy kryształy, w których występują wiązania kowalencyjne; krzem posiada LK4(jest otoczony 4 atomami azotu); atom azotu inaczej niż węgiel łączy nie 4 a 3 naroża tetraedrów; posiada dwie odmiany strukturalne: α-Si3N4 (topi się w niskich temperaturach, trygonalna komórka elementarna o symetrii P31c) oraz β- Si3N4 (topi się w wysokich temperaturach, heksagonalna komórka elementarna o symetrii P63/m; wiązanie Si-N jest bardzo silne dzięki czemu ten azotek jest odporny na działanie czynników zewnętrznych jak odkształcenia mechaniczne czy korozja; zastosowanie w specjalnej ceramice nietlenkowej. Nierozpuszczalny w kwasach organicznych, HF, odporny na utlenianie-pasywacja, sublimuje w wysokich temperaturach.
Halogenki krzemu.
Halogenki krzemu tworzą wszystkie fluorowce; posiadają wzor ogolny SiX4 ; mogą tworzyć polifluorowce (SiX2)n lub (SiX)n (X=F,Cl,Br,I). najpopularniejsze są fluorki krzemu, a konkretnie czterofluorek krzemu o SiF4 , który powstaje w wyniku reakcji trawienia szkła (reakcja) kwasem fluorowodorowym (HF). SiF4 - to bezbarwny gaz o drażniącym zapachu, silnie dymiący w powietrzu (ponieważ ulega pod wpływem pary wodnej hydrolizie); reaguje z nadmiarem HF tworząc wyższe fluorosilany.
Warto zauważyć istnienie czterochlorku krzemu, który ma zastosowanie jako substancja wyjściowa do otrzymywania pochodnych organicznych krzemu oraz do otrzymywania czystego krzemu dla elektrotechniki.
Znane są również inne halogenki (wzory).
Oksyhalogenki krzemu.
Tworzą trwałe połączenia, w których występuje mostek Si-O-Si gdzie atom fluorowca jest połączony z atomem krzemu; molekuły liniowe: wzór ogólny SinOn-1X2n+2 , molekuły cykliczne: wzór ogólny: (SiOX)n ; bezbarwne oleiste ciecze, rozpuszczalne w popularnych rozpuszczalnikach (CCl4, chloroform); hydrolizują.
Krzemowodory (silany).
Związki krzemu z wodorem o wzorze ogólnym: SinH2n+2 ; znane są silany posiadające do 15 atomów krzemu (dłuższe łańcuchy są bardzo nietrwałe); krzemowodory posiadają odmiany izomeryczne i pierścieniowe, istnieją również polisilany (SiH2)4 ; nie tworzy odpowiedników węglowodorów nasyconych, ponieważ wiązanie Si=Si nie istnieje; otrzymuje się je za pomocą reakcji krzemku magnezu (Mg2Si) z kwasami (HCl, HBr) bez dostępu tlenu; niższe krzemowodory są gazami, wyższe są łatwo lotnymi cieczami; rozkładają się w temp. ~500oC; łatwo utleniają się, reagują wybuchowo z fluorowcami (gdy użyjemy katalizatora AlCl3 - nie reagują wybuchowo).
Związki krzemoorganiczne.
SiC-SiO2
Rn(SiOR)4-n alkoksysilany
R (R2Si - O)nR oligo- i polisiloksany,
(R2SiO)n cyklosiloksany
(RSiO3/2)n silseskwioksany.
Mono i oligokrzemiany
Inokrzemiany (łańcuchowe)
Fyllokrzemiany (warstwowe)
Tektokrzemiany (szkieletowe)
Podział związków krzemoorganicznych ze względu na sekwencję wiązań:
- alkilosilany, R-Si
- alkilohalogenosilany, X-Si-R
- silanole R-Si-O-H
- silazany R-Si-N
- silanolaty R-Si-O-Me+
- siloksany R-Si-O-Si-R
- silseskwioksany (RSiO3/2)n
- silikaty (krzemiany) Si-O4R4
gdzie R oznacza alkil lub aryl, X - atom fluorowca
Alkilosilany i alkilohalogenosilany
Można je traktować jako pochodne silanów, w których atom wodoru został podstawiony alkilami lub/i atomami fluorowca; im więcej atomów wodoru zostaje podstawionych tym te związki stają się trwalsze i mniej reaktywne; pochodne chlorowcowe alkilosilanów ulegają hydrolizie tworząc silanole, a te kondensując tworzą siloksany (silikony) dzięki temu mają spore zastosowanie w chemii.
Silazany.
Związki zawierające wiązanie Si-N tarkowane jako aminowe.
Silanole, silanolaty, siloksany.
Są najważniejszą grupą związków krzemoorganicznych, w których występuje wiązanie Si-O; siloksany mogą tworzyć duże cząsteczki oparte na szkielecie wiązań Si-O-Si-O (łańcuchy i pierścienie) i wraz z estrami kwasu krzemowego, stanowią grupę związków blisko spokrewnioną z krzemianami, dlatego nazywamy je alkilokrzemianami lub krzemianami organicznymi.
Krzemiany(silikaty).
Definicja(na podstawie książki, trochę zmieniona)- krzemianami nazywamy związki chemiczne, które mają budowę krystaliczną lub amorficzną, ich podstawową jednostką strukturalną jest anion krzemo tlenowy (tetraedr krzemo tlenowy SiO4 ), który tworzy rozmaite struktury (łańcuchowe, warstwowe itd.) poprzez łączenie się naroży tych tetraedrów.
Są to substancje trwałe, topiące się w bardzo wysokich temperaturach, nierozpuszczalne w wodzie (oprócz krzemianów litowców). Krzem posiada w tych związkach koordynację równą 4. W sieci krystalicznej atomy krzemu mogą być zastępowane atomami innych pierwiastków które posiadają koordynację 4 (glin-glinokrzemiany, bor- borokrzemiany, beryl -berylokrzemiany, w niewielkim stopniu krzem może być podstawiany magnezem lub żelazem. Syntetyczne krzemiany powstają przez reakcję w wys. temp. między SiO2 a odpowiednimi tlenkami metali. Krzemiany występują w przyrodzie jako liczne krzemiany skałotwórcze, stanowią wagowo około 92% składu skorupy ziemskiej.
Wykład II
Podstawowe kryteria klasyfikacji krzemianów.
Istnieje pięć różniących się rzędowością rodzajów tetraedrów SiO4 . Z tetraedrów o różnej rzędowości można tworzyć złożone układy, takie złożone z kilku rodzajów tetraedrów grupy będziemy nazywać złożonymi anionami krzemotlenowymi.
Ładunki złożonych anionów krzemo tlenowych są kompensowane w strukturze kryształu przez kationy metali i ich rodzaj jest kolejnym powodem zróżnicowania struktur krzemianowych.
Trzecim powodem różnorodności krzemianów jest sposób ułożenia anionów krzemotlenowych i kationów w strukturę kryształu.
Dp wymienionych czynników należy również dodać zjawiska podstawień izomorficznych oraz przemiany polimorficzne.
Zasady systematyki krzemianów:
Rodzaj anionu krzemotlenowego -> struktura komórki elementarnej -> skład chemiczny.
Przykład:
Ca3Al2[SiO4]3 -monokrzemian glinowo-wapniowy (grossular)
Anion [SiO4] 4- -> Układ regularny o symetrii przestrzennej Ia3d (granaty) -> Ca3Al2[SiO4]3
Krystalograficzna klasyfikacja anionów krzemotlenowych.
Klasyfikacja Bragga.
Bragg wprowadził podstawową jednostkę strukturalną anionów - anion krzemotlenowy [SiO4], z którego można zbudować każdy złożony anion krzemotl.
Rodzaj anionu |
Przykłady anionu |
Stosunek (T : O) |
Ortokrzemiany |
[SiO4]4- |
1 : 4 |
Grupowe |
[Si2O7]6-, [Si3O10]8- itd. |
od 1 : 3.5 do 1 : 3 |
Łańcuchowe |
[TO3]2- |
od 1 : 3 do 1 : 2.5 |
Warstwowe |
[T4O10]4- |
1 : 2.5 |
Szkieletowe |
[TO2] |
1 : 2 |
Klasyfikacja ta uwzględnia inne atomy tetraedryczne podstawiane w miejsce krzemu (glin, beryl, bor, german itp.) jednak ilość podstawionych at. Nie może być większa niż 50% w stosunku do ilości atomów krzemu(reguła Loevensteina).
Klasyfikacja Kostova nie będzie przez nas stosowana, ponieważ częściej jest używana do nauk o ziemi (geologii, geochemii) niż dla krystalochemii krzemianów.
Klasyfikacja Zoltaia.
Grupa główna |
Podgrupy |
fsh |
T:O |
1. Izolowane tetraedry lub grupy tetraedrów |
- pojedyncze - podwójne - potrójne - duże grupy - mieszane |
1.00 1.25 1.33 1.33 -1.50 1.00 -1.50 |
1 : 4 1:3.5 1:3.33 1:3.33 - 1:3 1:3.67 - 1:3 |
2. Aniony liniowe - polimery 1-wymiarowe |
- łańcuchy pojedyncze - pierścienie pojedyncze - łańcuchy podwójne - pierścienie podwójne - łańcuchy wielokrotne - pierścienie wielokrotne - mieszane |
1.50 1.50 1.50 -1.75 1.50 -1.75 1.50 - 2.00 1.50 - 2.00 1.50 - 2.00 |
1 : 3 1 : 3 1:3 - 1: 2.5 1:3 - 1: 2.5 1:3 - 1:2 1:3 - 1:2 1:3 - 1:2 |
3. Aniony warstwowe - polimery 2-wymiarowe |
- pojedyncze warstwy - podwójne warstwy - warstwy wielokrotne - warstwy mieszane |
1.50 - 2.00 1.50 - 2.00 1.50 - 2.00 1.50 - 2.00 |
1:3 - 1:2 1:3 - 1:2 1:3 - 1:2 1:3 - 1:2 |
4. Struktury szkieletowe - polimery 3-wymiarowe |
Sieć przestrzenna tetraedrów |
1.50 - 2.00 |
1:3 - 1:2 |
5. Aniony mieszane |
|
|
|
fsh -współczynnik podziału, który jest równoważny stosunkowi T:O, a opisuje stopnień polikondensacji tetraedrów w anionie. Jest bardzo ważnym parametrem ponieważ określa rzędowość tetraedru. Oprócz współczynnika podziału ważne są również dwa inne kryteria, mianowicie: liczba tetraedrów w anionie i przemienność w wypadku anionów polimerycznych (liczba tetraedrów w powtarzającej się sekwencji tetraedrów nieskończonego łańcucha; krotność pierścieni może być traktowana jako równoważna przemienności).
Klasyfikacja Liebaua.
Parametry klasyfikacji Liebaua:
1. liczba koordynacyjna krzemu (CN - coordination number), która może
przyjmować wartości 4, 5 i 6 ale najczęściej 4,
2. liczba łączeń - wspólnych naroży (L - linkedness ), dwa poliedry mogą się w
ogóle nie łączyć (wówczas L=0) lub łączyć jednym wspólnym narożem (L=1),
wspólną krawędzią (L=2) lub wspólną ścianą (L≥3),
3. rzędowość tetraedru - liczba tlenów mostkowych (s -connectedness ), s = 0, 1, 2,
3, 4 co oznacza odpowiednio brak tlenu mostkowego, jeden, dwa, trzy i cztery
tleny mostkowe w jednym tetraedrze (por.rozdz.4.1),
4. liniowość lub rodzaj rozgałęzienia anionu (B - branchedness), tworzące złożony
anion poliedry mogą łączyć tworząc proste, liniowe łańcuchy lub łańcuchy
rozgałęzione a nawet łańcuch z pętlami,
5. wymiar anionu (D - dimensionality ) oznacza wymiar polimeryzacji złożonych
anionów, gdy D = 0 anion jest niepolimeryczny a więc składa się z jednego lub
policzalnej liczby poliedrów, gdy D = 1 polimeryczny anion jest spolimeryzowany
w jednym wymiarze zaś gdy wartość D wynosi dwa lub trzy polimer
rozbudowany jest w odpowiednio w dwóch i trzech wymiarach,
6. wielokrotność anionu (M - multiplicity) oznacza liczbę pojedynczych elementów
w anionie o takim samym wymiarze, a więc w przypadku niepolimerycznych to
liczba tetraedrów, liczba pierścieni, dla polimerów łańcuchowych liczba
łańcuchów a dalej liczba warstw dla D = 2.
7. powtarzalność ułożenia anionu (P - periodicity) jest istotna dla anionów o
znacznej liczbie tetraedrów i oznacza liczbę tetraedrów w powtarzającej się
sekwencji ułożenia tych tetraedrów w złożonym anionie.
Ta klasyfikacja jest bardzo precyzyjna, a wręcz posiada zbyt wiele parametrów. Pierwsze dwa parametry tej klasyfikacji są stałe i struktury krzemotlenowe nie stosują się do tej zasady.
Proponowana klasyfikacja anionów krzemotlenowych.
Podstawowe kryteria stosowane hierarchicznie porządkują wystarczająco dokładnie wszystkie możliwe aniony krzemotlenowe:
Wymiar anionu D,
Wielokrotność M,
Rzędowość s,
Powtarzalność P.
Wymiar D anionu.
Może przyjmować 4 wartości: D=0 (dla anionów zbudowanych z jednego tetraedru SiO4 lub z policzalnej ich liczby; aniony niepolimeryczne); D=1 (dla łańcuchowego anionu polimerycznego, polimeryzacja w jednym kierunku); D=2 (dla warstwowego anionu polimerycznego, polimeryzacja w dwóch kierunkach); D=3 (dla szkieletowej struktury polimerycznej, polimeryzacja w trzech kierunkach).
Wielokrotność M anionu.
Jest to liczba elementów o takim samym wymiarze tworzących złożony anion; w przypadku gdy D=0 jest to liczba tetraedrów, D=1 liczba łańcuchów, D=2 liczba warstw, D=3 nie ma sensu określać.
Rzędowość s anionu.
Może przyjmować wartości 0,1,2,3,4 oznacza ilość mostkowych atomów tlenu w jednym tetraedrze; rzędowość decyduje o kształcie anionu; dla wielu połączonych tetraedrów przyjmuje wartość średnią.
Powtarzalność P anionu.
Jest to liczba tetraedrów tworzących powtarzających się w jednym, dwóch lub trzech kierunkach sekwencję tetraedrów o takiej samej orientacji przestrzennej.
Rodzaje anionów krzemotlenowych.
1. Niepolimeryczne krzemiany (D-0):
mono-, oligo- i cyklokrzemiany,
2. Inokrzemiany (D = 1) - łańcuchowe,
3. Fyllokrzemiany (D = 2) - warstwowe,
4. Tektokrzemiany (D = 3) - szkieletowe.
Niepolimeryczne aniony krzemianowe.
Takie aniony dzielimy na trzy grupy:
Monokrzemiany- występują pojedyncze tetraedry (M=1, s=0);
Oligokrzemiany- są zbudowane z kilku tetraedrów tworzących prosty lub rozgałęziony łańcuch;
Cyklokrzemiany - to Oligokrzemiany zbudowane z kilku tetraedrów, ale tworzących pierścień (pojedynczy lub podwójny); w pierścieniu pojedynczym wszystkie tetraedry są drugorzędowe (s=2), zaś w pierścieniu podwójnym tylko trzeciorzędowe (s=3).
Wzór ogólny oligoanionów:
[SiMO3M+1](2M+2)- gdzie M-liczba tetraedrów (atomów krzemu) w anionie.
Aniony inokrzemianowe- struktury łańcuchowe.
Inokrzemiany z greckiego inos oznaczające „nić”; Inokrzemiany mogą być proste (występują wyłącznie tetraedry drugorzędowe) i rozgałęzione (występują różne rzędowości tetraedrów); uporządkowanie łańcucha w przestrzeni to periodyczność przemienność) P w łańcuchach występuje orientacja „trans”, ponieważ orientacja „cis” jest energetycznie niekorzystna; wzór ogólny łańcucha: [PSiPO3P]2P- ∞ P- przemienność; łańcuchy rozgałęzione mogą utworzyć drugi łańcuch tworząc w ten sposób łańcuch podwójny (M≤5) nazywamy je oligoinokrzemianami; w dipolianionie mamy możliwe trzy kombinacje połączenia między łańcuchami: co trzeci, co drugi i każdy; im wyższa przemienność łańcucha tym większa możliwość różnych rodzajów łączenia w dipoli aniony; rzadko podwójne łańcuchy są rozgałęzione.
Aniony fyllokrzemianowe- struktury warstwowe.
Powstają przez połączenie wspólnymi narożami nieskończonej liczby łańcuchów, w tak utworzonej warstwie każdy tetraedr jest trzeciorzędowy; tlen terminalny-nie połączony mostkiem; warstwy mogą być pojedyncze, podwójne, lub wielokrotne (mono-, di-, oligofyllokrzemiany); struktura będzie zależała od przemienności łańcucha; orientacja przestrzenna (konformacja) różni poszczególne rodzaje warts o tych samych parametrach; monofylloaniony tworzą wyłącznie pierścienie sześcioczłonowe, w warstwach o wyższej przemienności rodzaj pierścieni będzie zależał od wzajemnej orientacji połączonych w warstwę łańcuchów; rodzaj pierścieni może służyć jako kryterium porządkujące typ anionów.
Tektokrzemiany- struktury szkieletowe.
Struktury szkieletowe można wyprowadzić przez połączenie łańcuchów w dwóch kierunkach prostopadłych do łańcucha lub przez połączenie warstw w jednym kierunku prostopadłym do płaszczyzny warstwy; nie ma tlenów terminalnych bo każdy jest mostkowy, w takim wypadku każdy ładunek tlenu i krzemu jest bilansowany i trudno mówić o polianionie (polianiony powstają tylko wtedy kiedy zamiast krzemu mamy podstawiony atom np. glinu (Al3+ ), boru (B3+), berylu (Be2+)- wtedy dopiero możemy mówić o tektoanionach); parametr M w strukturach szkieletowych nie jest potrzebny, ponieważ nigdy nie wynosi więcej niż 1, zamiast parametru P(przemiennością) wygodniej jest się posłużyć krotnością pierścieni.
Zasady zapisywania wzorów krzemianów.
Nazwa chemiczna (mineralogiczna) |
Wzór tlenkowy |
Wzór chemiczny |
Monokrzemian wapniowo-glinowy (grossular) Fylloglinokrzemian wapniowo-glinowy (margaryt) tektoglinokrzemian wapniowy (anortyt) |
3 CaO · Al2O3 · 3 SiO2
CaO·2Al2O3·2SiO2·H2O
CaO · Al2O3 · 2SiO2
|
Ca3Al2[SiO4]
CaAl2[Al2Si2O10](OH)2
Ca[Al2Si2O8] |
Wzór tlenkowy- oprócz składu chemicznego informuje o stopniu utlenienia pierwiastków względem tlenu;
Wzór koordynacyjny- wyróżniają grupy atomów, które tworzą wielościany koordynacyjne lub grupy funkcyjne, informują one więc nie tylko o składzie chemicznym, ale także częściowo o strukturze związku;
Wzór strukturalny- dostarcza informację strukturalną rozumiana jako podanie sposobu łączenia się pierwiastków w związek.
Wzór np. NaCl nie wyróżnia molekuł, podaje tylko stosunek pierwiastków w krysztale (dla związków krystalicznych nie stosujemy więc wzorów strukturalnych); w przypadku krzemianów będziemy stosować tylko wzory koordynacyjne i tlenkowe.
Wzory koordynacyjne krzemianów:
Anion krzemotlenowy
[P(Si,T)x Oy(OH)z]∞n-
Krzemian, glinokrzemian, borokrzemian itp
Me+aMe2+bMe3+c[P(Si,T)xOy(OH)z]n- OH-, X- · n H2O
Wiązanie chemiczne w kryształach.
Wyróżniamy dwa rodzaje struktur: homodesmiczne i heterodesmiczne. Homodesmiczne struktury to takie, które posiadają wyłącznie jeden rodzaj wiązań. Najsilniejszym wiązaniem jest w. atomowe, które powstaje w wyniku przesunięcia pary elektronów symetrycznie między obydwa atomy (taki przypadek występuje pomiędzy atomami tego samego pierwiastka); z w. atomowego w wyniku polaryzacji powstaje w. jonowe, z delokalizacji elektronów- w. metaliczne (które jest najsłabsze spośród tych trzech wiązań). Przykład struktur homodesmicznych: diament, CsF, NaCl itd. W strukturach heterodesmicznych występuje kilka rodzajów wiązań, np.: CH3COONa, H2SO4 .
Wiązanie krzem-tlen.
Orbitale krzemu ulegają hybrydyzacji dzięki czemu powstają 4 równocenne energetycznie orbitale zdolne do wytworzenia wiązania. Obraz graficzny stanowi figura, której orbitale są skierowane do naroży czworościanu umiarowego (tetraedru). Krzem tworzy wiązanie chemiczne z tlenem poprzez nałożenie się czterech orbitali typu sp3 krzemu z orbitalem typu p tlenu, tworząc cztery wiążące orbitale molekularne typu σ. Zostają jednak 4 niesparowane elektrony zdolne do wytworzenia wiązania, w ten sposób powstaje anion krzemotlenowy [SiO4]4- . W wiązaniach krzem-tlen atomy tlenu mają dwie niewiążące pary elektronów, które mogą tworzyć z pustymi orbitalami d krzemu wiązanie typu πd-p i w konsekwencji wiązanie Si-O może mieć rząd większy od jedności. Wiązanie Si-O będzie częściowo jonowe, ponieważ elektrony tworzące orbital wiążący przesuną się w kierunku bardziej elektroujemnego tlenu. Traktując wiązanie krzem-tlen w kategoriach modelu jonowego, w anionie [SiO4]4- ujemne jony tlenu ułożą się w narożach czworościanu foremnego, a w luce między nimi ulokuje się dodatni kation krzemu. Dominujący charakter w krzemianach będzie miało wiązanie jonowe.
Krzemiany jako struktury jonowe.
Rozważmy podstawowe parametry tetraedru, które są różne w różnych strukturach, a więc są zależne od otoczenia tetraedru, i tak:
- Długość wiązania Si-O wynosi od 1.57 do 1.72Å (średnio 1.62Å),
- Kąt między wiązaniami O-Si-O od 98o do 122o (średnio 109,47o),
- Kąt między tetraedrami Si-O-Si od 120o do 180o (średnio 140o).
Wiązanie mostkowe Si-O-Si wynosi: 1,608 Å; wiązanie terminalnego Si-O- wynosi: 1,638 Å (np. w monokrzemianach). Jednak w przypadku gdy mamy bezpośrednie sąsiedztwo obydwu typów wiązania Si-O, relacje między długościami tych wiązań się odwracają (kontrapolaryzacja). Z tych rozważań wynika jak różne może być wiązanie krzem-tlen w strukturach krzemianowych. Charakter wiązania Si-O jest tylko w połowie jonowy więc wynikająca z I reguły Paulinga (gęste upakowanie) zależność, iż odległość miedzy jonami jest sumą promieni jonowych jest tylko spekulacją, w rzeczywistości suma promieni jonowych krzemu i tlenu jest mniejsza od zmierzonej odległości między tymi jonami. Rozbieżność ta wynika z pośredniego między atomowym a jonowym (atomowe spolaryzowane) charakteru wiązania Si-O, dlatego należy uważać przy stosowaniu określenia, że to wiązanie jest częściowo jonowe - jest to spolaryzowane wiązanie kowalencyjne.
Najczęściej stosowane metody do określania ładunków resztkowych:
-dyfrakcja rentgenowska (rozkład gęstości elektronowej);
-spektroskopia XPS;
-obliczenia metodami MO.
Najlepsze wyniki otrzymujemy poprzez zastosowanie dyfrakcji rentgenowskiej.
Z krótkich rozważań nad podstawowymi parametrami charakteryzującymi wiązanie krzem-tlen wynika, że nie można mówić o stałym i jedynym charakterze tego wiązania, ale o zróżnicowanych wiązaniach Si-O w zależności od otoczenia (struktury), które ma bezpośredni wpływ na jego parametry.
Najważniejsze czynniki różnicujące wiązanie krzem - tlen to:
1. terminalna (końcowa) lub mostkowa pozycja wiązania Si-O,
2. elektroujemność sąsiadującego z Si-Oterm kationu metalu,
3. kąt między tetraedrami w przypadku wiązania Si-Obr.(br- tlen mostkowy)
Wiązanie krzem-tlen terminalny (1,60 Å) jest nieco silniejsze od wiązania krzem-tlen mostkowy(1,66 Å).
Spełnienie reguł Paulinga dla struktur krzemianowych.
Pierwsza reguła-zasada koordynacji.
W trwałych strukturach kation otoczony jest anionami tak, ze tworzą one naroże wielościanu koordynacyjnego. Odległość kation - anion jest suma promieni jonowych. Liczba koordynacyjna zależy od stosunku promienia kationu do promienia anionu. Odstępstwo od gęstego upakowania jest przede wszystkim skutkiem tylko częściowo jonowego charakteru wiązania Si-O.
Druga reguła-zasada elektroobojętności.
Pokazuje ona czym łączą się wielościany miedzy sobą. To łączenie zależy od zasady elektroobojętności i od minimalizacji energii. Ładunek anionu musi być dokładnie lub niemal dokładnie wysycony przez wytrzymałość wiązania otaczających go kationów.
Trzecia reguła- zasada wspólnych naroży.
Wielościany koordynacyjne łączą się najczęściej w trwałych strukturach jednym narożem, rzadziej dwoma narożami (krawędzią), a zupełnie rzadko trzema lub więcej narożami, czyli ścianą. Chcą łączyć się możliwie najmniejsza liczba wspólnych naroży. Im więcej wspólnych naroży, tym bliższa odległość pomiędzy centrami wielościanów. Kationy są małe i mogą mieć duży ładunek, wiec chcą się maksymalnie odsunąć od siebie. Reguła ta wywodzi się z minimalizacji energii układu. Im więcej naroży, tym odległość miedzy kationami jest większa, co gwarantuje mniejsze odpychanie wielościanów.
Czwarta reguła- zasada samodzielnych kationów.
Silne kationy nie mogą mieć wspólnych naroży. S, P są ta silne kationy - posiadają duży ładunek i małą liczbę koordynacyjna. Tetraedr SiO4 nie może się łaczyć wspólnymi narożami z anionami takimi jak np. SO4, CO3, NO3.
Piąta reguła- zasada oszczędności.
Jeden kation nie może tworzyć więcej niż jeden typ anionu, np. w przypadku Si, który może występować jako tetraedr i oktaedr ([SiO4]4- i [SiO6]8-). W związku z tym jeżeli kationy wchodzą w skład różnych anionów to jeden z nich zdecydowanie przeważa w strukturze.
Podsumowując rozważania nad stosowalnością reguł Paulinga dla struktur krzemianowych, można stwierdzić, że mimo w połowie jonowego charakteru wiązania Si-O reguły te stosują się dobrze. Potwierdza to słuszność wyboru modelu jonowego do opisu struktur krzemianowych.
Izomorfizm w krzemianach.
Izomorfizm to zjawisko gdy dwie lub więcej substancji izotypowych tworzy roztwory stałe a mieszające się związki nazywamy roztworem stałym (szeregiem) izomorficznym.
Przykładowe roztwory stałe
K(Cl,Br) - roztwór stały KCl i KBr
(Mg,Fe)2[SiO4] roztwór stały Mg2[SiO4] i Fe2[SiO4]
Izotypia lub izostrukturalność to występowanie różnych związków w tej samej strukturze krystalicznej Związki izotypowe mają zwykle podobne wzory chemiczne.
Typ AB np. NaCl, PbS, MgO
Typ A2[BX4] np. Mg2[GeO4] i Li2[BeF4]
Związek chemiczny to faza różniąca się typem sieci od swych składników.
Roztwór stały to faza zawierająca co najmniej dwa składniki przy czym jej typ sieci jest identyczny z typem sieci jednego ze składników (rozpuszczalnika) a parametry sieci są ciągłą funkcją składu chemicznego.
Ze względu na sposób obsadzania miejsc w sieci krystalicznej rozróżniamy zasadniczo trzy rodzaje roztworów stałych:
1. Roztwory stałe substytucyjne (podstawieniowe)
2. Roztwory stałe interstycjalne (międzywęzłowe, śródwęzłowe)
3. Roztwory stałe substrakcyjne (pustowęzłowe)
Warunki powstawania roztworów izomorficznych:
Geometryczne - podobieństwo promieni
Różnice do 15 % związki mogą tworzyć roztwory stałe
Różnice 15-25 % roztwory stałe w wyższych temperaturach z ograniczoną mieszalnością w niskich temperaturach.
Różnice ponad 25 % nie tworzą się roztwory stałe
W strukturach innych niż jonowe pojawia się drugi warunek - charakter wiązania.
Roztwory substytucyjne:
-podobny promień jonowy +/- 15% w temperaturze pokojowej
- ten sam typ wzoru chemicznego
-ten sam ładunek (może być Na+Si+4 - Ca+2Al+3)
-ten sam typ sieci
-podobna elektroujemność.
Podstawienia w krzemianach
- izowalentne: Na+ ↔ K+ , H3O+ ↔ K+, F- ↔ OH- ,
Mg+2 ↔ Fe+2, Mg+2 ↔ Mn+2, Fe+2 ↔ Mn+2, Mn+2 ↔ Zn+2,
Al+3 ↔ Fe+3, Fe+3 ↔ Cr+3, Si+4 ↔ Ge+4, Si+4 ↔ Ti+4,
- heterowalentne: Si+4 ↔ K+ Al+3, Na+ Si+4 ↔ Ca+2 Al+3, K+ Si+4 ↔ Ca+2 Al+3,
H3O+ Al ↔ Si+4, Mg+2Si+4 ↔ Al+3 Al+3.
Podstawowe typy diagramów fazowych z roztworami stałymi:
Układ z nieograniczoną mieszalnością w fazie stałej
Układ z zakresem niemieszalności w subsolidusie
Układ z ograniczoną mieszalnością z eutektyką dwóch roztworów stałych
Układ perytektyczny
Szereg izomorficzny oliwinów
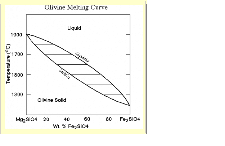
- do 10% Fe+2 forsteryt,
- 10%- 30%Fe+2 oliwin właściwy,
- 30% - 50% Fe+2 hialosyderyt,
- 50% - 70% Fe+2 hortonolit,
- 70% - 90%Fe+2 ferrohortonolit,
- ponad 90% Fe+2 fajalit.
Morfotropia
Jest to zjawisko zmiany struktury w szeregu izomorficznym wywołanej podstawieniem jonów.
Zn2[SiO4] → (Zn,Mn)2[SiO4] → (Mn,Zn)2[SiO4] → Mn2[SiO4]
willemit (tryg.) trustyt (tryg.) reperyt (romb.) tefroit (romb.)
Polimorfizm w krzemianach.
Polimorfizm (wielopostaciowość)- To zjawisko występowania związku chemicznego o takim samym składzie chemicznym w wielu różnych strukturach krystalicznych. Polimorfizm pierwiastków nazywamy alotropią. W rozumieniu termodynamicznym różne formy krystaliczne związku to różne fazy tego związku i dlatego przejście od jednej struktury do drugiej będzie przemianą fazową.
Rodzaje przemian polimorficznych
Fazowe przemiany polimorficzne:
Przemiany I rodzaju:
Enancjotropowe:
-przemieszczenie
-przebudowa
b. monotropowe
-przemieszczenie
-przebudowa
2.przemiany II rodzaju.
Diagram fazowy enecjotropii:
Diagram fazowy monotropii:
Układ jednoskładnikowy SiO2 według Fennera:
Ukad jednoskładnikowy Ca2[SiO4]:
Wyszukiwarka
Podobne podstrony:
13. Miareczkowanie amperometryczne, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metod
Regulamin i terminy laboratorium 2014, Technologia Chemiczna, Rok II, Semestr II, Nauka o Materiałac
03. Roztwarzanie materiałów w kwasach i przez stapianie, Technologia Chemiczna, Rok III, Semestr II,
Zadanie z fizycznej, Technologia chemiczna, rok II
04. Metody rozdzielania, Technologia Chemiczna, Rok III, Semestr II, Instrumentalne metody analizy,
02. Pobieranie prób i kalibracja sprzętu analitycznego, Technologia Chemiczna, Rok III, Semestr II,
ZAKRES MATERIAŁU PIM, Technologia Chemiczna, Rok III, Semestr I, Podstawy inżynierii materiałów, Sem
Zagadnienia egzaminacyjne 2014, Technologia Chemiczna PK, II rok, maszynoznastwo
ustny maszyny, Technologia chemiczna, I stopień, II rok, Maszynoznawstwo
Maszynoznawstwo teoria, Technologia Chemiczna PK, II rok, maszynoznastwo
CHEMIA ORGANICZNA REAKCJE sciaga 111, Technologia chemiczna, 3 semestr, Chemia organiczna, wykłady
Chemia analityczna - zestawy egzaminacyjne, Technologia Chemiczna PW, III SEMESTR, Chemia analityczn
REDOKS, Technologia Chemiczna, Rok I, Chemia
ZADANIE A7(5), Radzion Dorota , technologia chemiczna , rok III , grupa III
Zakres materiału, Technologia Chemiczna, Rok I, Fizyka, Wykłady fizyka
ZADANIE A7(3), Radzion Dorota , technologia chemiczna , rok III , grupa III
ZADANIE A7(3), Radzion Dorota , technologia chemiczna , rok III , grupa III
więcej podobnych podstron