CHEMIA 1 (17.02.2006)
UKŁADY BIOLOGICZNE JAKO UKŁADY OTWARTE:
chemia organizmów żywych opiera się prawie wyłącznie na związkach węgla;
zależy od reakcji przebiegających prawie wyłącznie w wodzie;
komórki są bardziej złożone niż jakikolwiek układ chemiczny;
chemia komórek jest zdominowana przez cząsteczki polimerowe;
komórka wykształciła mechanizmy kontrolne, zapewniające zachodzenie wszystkich reakcji chemicznych we właściwym miejscu i czasie;
UKŁAD / OTOCZENIE:
parametry stanu: p, V, T, n (układ - fragment wszechświata podlegający naszym badaniom; otoczenie - wszystko to znajdujące się poza układem);
stan równowagi - parametry układu nie zależą od temperatury;
proces odwracalny - może zachodzić w obie strony, nie pozostawiając zmian w otoczeniu (proces nieodwracalny - zachodzi w jednym kierunku, drugi kierunek jest możliwy, ale ze zmianą w otoczeniu);
funkcje termodynamiczne: U, H, S, F, G (H, S, G - w organizmie);
ZMIANA ENERGII:
otwarte (wymiana z otoczeniem energii i masy);
zamknięte (wymiana z otoczeniem energii);
izolowane (brak wymiany energii i masy);
adiabatyczne (wymiana z otoczeniem na sposób pracy);
układy biologiczne są układami otwartymi!
KIERUNEK WYMIANY ENERGII:
reakcje egzoergiczne (energia z układu do otoczenia) ΔG<0 (G produktów < G substratów);
reakcje endoergiczne (energia z otoczenia do układu) ΔG>0;
SPOSÓB PRZEKAZYWANIA ENERGII:
wymiana na sposób ciepła (Q);
wymiana na sposób pracy (W);
EFEKT ENERGETYCZNY REAKCJI:
reakcja egzotermiczna ΔH<0 (układ oddaje ciepło do otoczenia);
reakcja endotermiczna ΔH>0 (układ pobiera ciepło z otoczenia);
zmiana entalpii jest równa różnicy między entalpią produktów i entalpią substratów i nie zależy od drogi przemiany!
niektóre przemiany są możliwe bez zmiany entalpii, bo zmienia się sposób uporządkowania układu (S - wartość dodatnia);
układ dąży do stanu o minimalnej energii i maksymalnym nieuporządkowaniu;
równanie Gibbsa-Helmholtza ΔG = ΔH - TΔS ΔG<0
warunek samorzutności reakcji ΔG<0! (reakcja samorzutna - termodynamicznie możliwa);
jeżeli ΔG=0 układ osiągnął stan równowagi dynamicznej;
RÓWNANIE GIBBSA-HELMHOLTZA:
ΔG = ΔH - TΔS ΔG<0 |
|||
reakcja egzotermiczna |
ΔH<0 |
ΔS>0 |
samorzutna |
|
ΔH<0 |
ΔS<0 |
samorzutna w niskich temperaturach |
reakcja endotermiczna |
ΔH>0 |
ΔS>0 |
samorzutna w wysokich temperaturach |
|
ΔH>0 |
ΔS<0 |
niesamorzutna w dowolnej temperaturze |
kierunek reakcji przewidujemy w oparciu o zmianę entalpii swobodnej;
w organizmach żywych procesy są endoergiczne (ΔG1>0), zachodzą dzięki sprzężeniu przez wspólny reagent (np. ATP) z procesami egzoergicznymi (ΔG2<0); |ΔG1|<|ΔG2|;
procesy fizjologiczne są endoergiczne (transport substancji przez błonę komórkową wbrew gradientowi, przewodzenie impulsów nerwowych, skurcz mięśni, synteza makrocząsteczek);
energia potrzebna do przeprowadzenia tych procesów czerpana jest z energii słonecznej magazynowanej w procesie fotosyntezy (poprzez łańcuchy pokarmowe);
energia zmagazynowana w pokarmach może być przekazywana w procesach endoergicznych nie bezpośrednio, lecz poprzez utlenianie, w którym jest przekształcona w związki bogate w energię (związki wysokoenergetyczne);
RÓWNOWAGA CHEMICZNA / KINETYKA CHEMICZNA:
entalpia swobodna wyznacza zarówno kierunek procesu jak i stan jego równowagi;
ΔG=0 układ znajduje się w stanie równowagi;
ujemna wartość ΔG oznacza, że reakcja jest samorzutna, ale nie oznacza to, że reakcja będzie przebiegała z wystarczającą szybkością;
TEORIA ZDERZEŃ - aby zderzenie było zderzeniem efektywnym, a więc aby doprowadziło do zajścia reakcji, reagujące cząsteczki musza posiadać energię większą od pewnej określonej energii granicznej, czyli energii aktywacji (różnej dla różnych reakcji);
TEORIA KOMPLEKSU AKTYWNEGO - cząsteczki w chwili zderzenia tworzą kompleks przejściowy, który posiada energię niezbędną do zajścia reakcji, który rozpadając się, może dawać zarówno produkty jak i substraty;
szybkość reakcji chemicznej jest proporcjonalna do ilości cząstek posiadających energię większą od energii aktywacji;
wszystkie reakcje chemiczne są odwracalne:
w stanie równowagi nie obserwujemy zmian w ilości poszczególnych składników reakcji (substratów i produktów), chociaż reakcja przebiega w obu kierunkach; (stan równowagi dynamicznej - stan równowagi, ale reakcja zachodzi);
układ znajduje się w stanie równowagi, jeżeli jego parametry nie zależą od czasu;
zmiana parametru w czasie oznacza przejście układu z jednego do innego stanu równowagi;
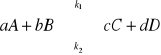
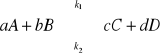
reakcja odwracalna, jednoetapowa, w stałej temperaturze:
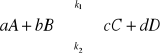
każda reakcja przebiega z określoną szybkością:
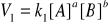
(równanie iloczynowe kinetyczne), gdzie k1 - stała szybkości reakcji, [A] i [B] - stężenie molowe substratów;miarą szybkości reakcji jest zmiana stężenia substratów lub produktów w jednostce czasu;
szybkość reakcji zależy od szybkości najwolniejszego substratu;
![]()
![]()
SZYBKOŚĆ DANEJ REAKCJI ZALEŻY OD:
stężenia substratów;
temperatury (im wyższa, tym większa szybkość) równanie Arrheniusa (zwiększamy energię kinetyczną cząsteczek i ich zderzenia mogą być bardziej efektywne);
obecność katalizatorów;
* ostatnie dwa czynniki są zależne od k;
![]()
![]()
![]()
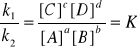
K - stała równowagi dynamicznej
![]()
![]()
stan równowagi dynamicznej dla danej reakcji chemicznej zależy wyłącznie od temperatury!
T = const K = const;
stała równowagi nie zależy od stężeń reagentów;
PODWYŻSZENIE / OBNIŻENIE TEMPERATURY UKŁADU:
reakcja egzotermiczna (ΔH<0) |
T ↑ ( i K↓) |
T↓ ( i K↑) |
reakcja endotermiczna (ΔH>0) |
T ↑ ( i K↑) |
T↓ ( i K↓) |
N2(g) + 3H2(g) ↔ 2NH3(g)
k1[H2]3[N2] = k2[NH3]2
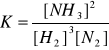
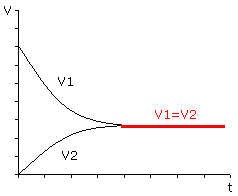
rozpoczynamy reakcję od mieszaniny N2 i H2; reakcja osiągnie stan równowagi dynamicznej - układ będzie zawierał H2, N2 i NH3 w określonych stężeniach;
rozpoczynamy reakcję od mieszaniny NH3; reakcja osiągnie stan równowagi dynamicznej - układ będzie zawierał H2, N2 i NH3 w określonych stężeniach;
k1[H2]3[N2] = k2[NH3]2
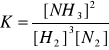
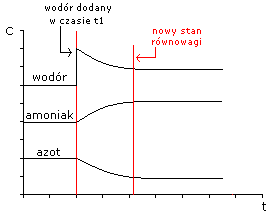
REGUŁA LE CHÂTELIER-BROWNA:
(reguła przekory)
N2(g) + 3H2(g) ↔ 2NH3(g)
jeżeli H2↑ 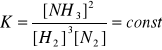
[N2]↓ [H2]↓ [NH3]↑
zmniejszenie lub zwiększenie stężenia jednego z reagentów; (K = const);
zmniejszenie lub zwiększenie objętości układu na skutek zwiększenia lub zmniejszenia ciśnienia; (K = const);
podwyższenie lub obniżenie temperatury układu; (K ≠ const!);
Na wydajność reakcji (przesunięcie równowagi w prawo) mogą wpływać:
nadmiar jednego z substratów (usuwanie jednego z produktów);
ogrzewanie układu dla reakcji endotermicznych, ochładzanie dla reakcji egzotermicznych;
wzrost ciśnienia dla reakcji ze zmniejszeniem objętości reagentów;
REAKCJE ASOCJACJI I DYSOCJACJA TLENU I WODY:
HHb + O2 ↔ HbO2- + H3O+
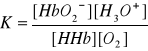
wysokie ciśnienie parcjalne tlenu w płucach sprzyja przesunięciu równowagi w prawo;
zwiększenie stężenia jonów hydroniowych w tkankach umożliwia dysocjację oksyhemoglobiny;
KATALIZA:
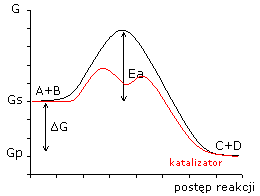
katalizator obniża energię aktywacji;
(Gs i Gp pozostają bez zmian)
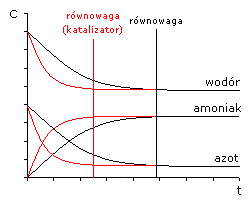
katalizator przyspiesza osiągnięcie stanu równowagi dynamicznej;
KATALIZA HOMOGENICZNA - zachodzi w układzie jednorodnym; katalizator występuje w tej samej fazie, co reagujące substraty, np. hydroliza sacharozy przebiega szybciej w środowisku kwaśnym;
KATALIZA HETEROGENICZNA - zachodzi w układzie niejednorodnym; katalizator stanowi odrębną fazę układu;
ENZYMY - katalizatory białkowe odpowiedzialne za przyspieszanie procesów biochemicznych organizmie żywym;
obniżenie energii aktywacji:
enzymy przyspieszają jedynie reakcje termodynamicznie możliwe (ΔG<0);
każdy układ dąży do wzrostu nieuporządkowania;
żywe komórki wytwarzają stan uporządkowania wykorzystując entalpię swobodną, zawartą w związkach, będących pożywieniem i dzięki uwalnianiu jej w postaci energii cieplnej;
organizmy są układami otwartymi;
hydroliza sacharozy |
energia aktywacji[kJ/mol] |
w środowisku kwaśnym |
1090 |
enzymatyczna |
46 |
II ZASADA TERMODYNAMIKI:
2
Wyszukiwarka
Podobne podstrony:
2936
met5zn regresja student id 2936 Nieznany
2936
2936
AVT 2936 Zegar id 74056 Nieznany (2)
2936
2936
2936
2936
więcej podobnych podstron