0000074 (4)

padku węgla C wiadomo, że zhybrydyzowane chmury elektronowe węgla tworzą strukturę tetraedryczną (czworościenną) (ryc. 2.4). Jeżeli każdy elektron zwiąże się z jednym elektronem czterech atomów sąsiednich, utworzy się sieć przestrzenna odpowiadająca kryształowi diamentu (ryc. 3.10).
Jest to sieć o złożonej strukturze regularnej, o niezbyt gęstym upakowaniu. Każdy atom węgla ma tylko 4 najbliższych sąsiadów, czyli tak zwana liczba koordynacyjna, wyrażająca liczbę najbliższych sąsiadów w krysztale, wynosi 4. Wszystkie atomy węgla zatracają swoją indywidualność. Istnieje odmiana alotropowa węgla — grafit o struk-utrze odpowiadającej sieci heksagonalnej (ryc. 3.10), nie jest to jednak kryształ o czystych wiązaniach kowalencyjnych^ Możliwość występowania danej substancji w różnych strukturach krystalograficznych nazywa się polimorfizmem.
O
b
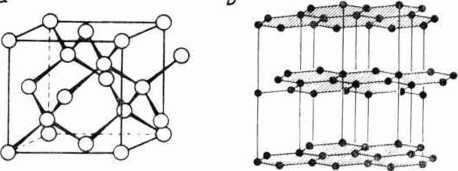
Ryc. 3.10. Modele odmian polimorficznych węgla: a — diament; b — grafit.
Wiązania kowalencyjne są niezwykle silne, o energii wiązania rzędu kilku do kilkunastu cV/atom. Kryształy o takich wiązaniach są twarde (diament, karborund), trudno topliwe, są przeźroczyste, nie przewodzą prądu elektrycznego — elektrony są zaangażowane w wiązaniach, nie mogą się przemieszczać w polu elektrycznym ani absorbować światła. Diament wyróżnia się jednak dobrym przewodnictwem ciepła. Przewodnictwo to nie wiąże się jednak—jak w metalach — ze swobodnymi elektronami, a z drganiami, jakie wykonują atomy wokół położenia równowagi w węzłach sieci. Małe atomy węgla łatwo poddają się tym drganiom i przenoszą je na atomy sąsiednie.
Wiązania metaliczne. Znaczna większość pierwiastków, bo ponad 70%, to metale. Wyróżniają się one szczególnymi właściwościami, które zawdzięczają wiązaniom metalicznym. Wiązania metaliczne można uważać za nienasycone wiazania kowalencyjne — atomy mają zbyt mało elektronów, żeby móc wspólnie utworzyć oktety. Dla przykładu: każdy atom Li, mając po jednym elektronie walencyjnym, nie ma możliwości utworzenia wiązań kowalencyjnych ze swoimi ośmioma sąsiadami w sieci regularnej, przestrzennie centrowanej, tak jak na ryc. 3.8, z tym, że wszystkie węzły będą obsadzone atomami litu. W efekcie wiążące się pary elektronów zmieniają ustawicznie swoje miejsca, każdy elektron przejściowo przynależy do coraz to innego atomu. Elektrony walencyjne uzyskują w ten sposób pewną swobodę, poruszają się pomiędzy pozbawionymi tych elektronów atomami metali. Sieć metaliczną tworzą więc atomy metali, związane wiązaniami metalicznymi, ich źródłem są skolektywizowane elektrony swobodne, zwane gazem elektronowym. Metale tworzą najczęściej sieci regularne lub heksagonalne o tzw. ciasnym upakowaniu, o dużej liczbie koordynacyjnej 8 czy nawet 12, stąd duża stosunkowo gęstość metali.
81
6 — Podstawy biofizyki
Wyszukiwarka
Podobne podstrony:
poel PODSTAWY ELEKTRONIKI — KOLOKWIUM I Temat B jeżeli wiadomo, że U = 10 V oraz r = 0,247 . Obliczy
Zdj cie0072 Teraz, kiedy wiadomo, że impuls elektryczny może spowodować potencja! czynnościowy, spró
strona (368) Prąd elektryczny i procesy kościotwórcze Od dawna wiadomo, że prąd elektryczny pobudza
Foto 0084 7. Klucz publiczny RS A to (n,e) = (65,7). Znajdź klucz prywatny. S. Wiadomo, że istnieje
Image027 tronicznego. Ilustracją tego zjawiska jest rys. 1.25, z którego wynika, że przejściu od ele
Image1�01 Wysokiej klasy przedwzmacmacz ze sterowaniem mikroprocesorowymNowy Elektronik 135-K Prezen
skanuj0533 96 Część I. Podstawy zarządzania strategicznego jest powierzchowna, podczas gdy wiadomo,
więcej podobnych podstron