185
Wielkość AIR = Ip (T0,p0) - lĄT^Pę), będącą efektem cieplnym reakcji w stanie standardowym, określa się mianem entalpii reakcji Różnice przyrostu entalpii produktów i substratów wyznacza zależność
AVA/. = E E *,W)-tATo)] (7.1.12)
prod. substr.
Jeśli reagenty są gazami doskonałymi, to ich entalpie właściwe i. zależą tylko od temperatury, molowe ciepła właściwe cpj są stałe, a wzór (7.1.12) przyjmuje postać
= E v*,(r-r0)- E vjcPj (T~To) (7.1.13)
prod. substr.
Entalpię reakcji oblicza się następująco
A/« = E v/A‘f - E V]AiF (7.1.14)
prod. substr.
gdzie Aip jest entalpią (ciepłem) tworzenia, tj. efektem cieplnym reakcji syntezy 1 kmola reagenta z najtrwalszych związków chemicznych w stanie standardowym. Entalpia tworzenia prostego pierwiastka, będącego w stanie standardowym w swojej najtrwalszej postaci, jest równa zeru. Wartości entalpii tworzenia związków chemicznych wyznacza się eksperymentalnie. Są one zebrane w specjalnych tablicach.
Efekt cieplny reakcji, równy zmianom entalpii dla reakcji zachodzącej przy p = const lub zmianom energii wewnętrznej przy V = const, nie zależy od drogi przemiany, tzn. nie zależy od tego, czy reakcja przebiegała bezpośrednio między stanami początkowym i końcowym, czy też na drodze kilku pośrednich reakcji zachodzących przy takim samym ciśnieniu i temperaturze {prawo Bessa). Pozwala to na wyznaczenie efektu cieplnego złożonej reakcji (trudnego do pomiaru) na podstawie znajomości efektów cieplnych reakcji prostszych.
Ilość ciepła wymienianego między układem i otoczeniem zależy od temperatury reakcji. Zmienność efektu cieplnego reakcji z temperaturą określają równania Kirchhojfa odpowiednio dla reakcji izobarycznej i izochorycznej
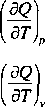
= E vjcpj(T)-Evjcpj(t) (7.1.15a)
prod. substr.
= E vicvj(T) - E vic,j(T) (7.1.15b)
prod. substr.
gdzie cpj lub cvj są molowymi cieplarni właściwymi reagentów (gazów doskonałych), tj. odniesionymi do 1 kmola reagenta (o mianie J-kmor^K"1). Całkowanie równań Kirchhoffa przy znanych zależnościach ciepeł właściwych w zakresie temperatur, przy których nie występują przemiany fazowe, pozwala wyznaczyć zmienność efektu cieplnego reakcji z temperaturą.
185
Wyszukiwarka
Podobne podstrony:
290 (12) W układzie równań (15.10) szukanymi wielkościami są szerokość i długość pozycji obserwowane
SL272405 Do opisu ruchu wprowadza się wielkość zwaną przyśpieszeniem. Przyśpieszenie średnie określa
Janusz Tadeusz Skotarczak, od 27 lat katecheta w Śremie wskazał najpierw na trudności związane z okr
JAK TO ZROBIĆ MAM 5 LAT (04) Ćwiczenie kształci umiejętność porównywania i spostrzegawczość. Dziec
JAK TO ZROBIĆ MAM 5 LAT (04) / Ćwiczenie kształci umiejętność porównywania i spostrzegawczość. Dzi
JAK TO ZROBIĆ MAM 5 LAT (05) Dziecko kształci spostrzegawczość i zmysł obserwacji, a także wprawia
JAK TO ZROBIĆ MAM 5 LAT (13) Dziecko doskonali logiczne myślenie i zmysł obserwacji. Wprawia się w
JAK TO ZROBIĆ MAM 5 LAT (14) Dziecko ćwiczy spostrzegawczość i umiejętność porównywania kształtów.
IP 5 Lights IP Sector Lights 40 o ......xs 18-12M /a? Sector light on standard
,. uzyczne ziarna o Wielkość ziarna - wyrównanie ziai określa się za pomocą sit Vo
HPIM7654 Sprawność napędu głównego określa się stosunkiem mocy skrawania Pe (kW) do mocy silnika Ps&
IMAG0162 (2) Właściwości fizyczne ziarna zbóż □ Wielkość ziania - w równani e ziarna, określa się za
IMAG0163 (2) Bi ■BiWłaściwości fizyczne ziarna zbóż □ Wielkość ziarna - wyrównanie ziarna, określa s
więcej podobnych podstron