CCF20150312�012 (2)

Terapia molekularna
• Proces fałdowania polipeptydu nazywany jest nawet wtórną translacją kodu genetycznego
i następuje bezpośrednio po syntezie cząsteczki w rybosomach.
• Zmianom właściwości fizykochemicznych białek
w następstwie mutacji genu, który je koduje, towarzyszy zaburzenie kształtu cząsteczki spowodowane zamianą aminokwasów.
• Częstym następstwem mutacji jest na przykład zwiększona podatność zmienionego białka na denaturację termiczną, zwana termolabilnością.
lf»n«aqa
tyouzcwiny porpłplyj
Htp70

teKtowari* <v»(*nł«y
oonwn
ySko/yWM
sounoMyna
Terapia molekularna
Komputerowe symulacje procesu fałdowania białka są jeszcze niedoskonałe. Wiadomo jednak, że zamiana aminokwasu polarnego na aminokwas pozbawiony ładunku elektrycznego powoduje szczególnie poważne zaburzenie kształtu fałdowanej cząsteczki.
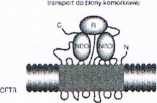
W komórkach znajdują się specjalne białka przyzwoitki (chaperons - czaperony) oraz enzymy, które wspomagają proces fałdowania i składania białek zbudowanych z wielu podjednostek.
Terapia molekularna
W dużej rodzinie białek "przyzwoitek" kalneksyna oraz białka szoku cieplnego (heat shock protein - Hsp) Hsp60 i Hsp70 wydają się najważniejsze, ze względu na udział w patomechanizmach chorób.
Dwa enzymy, które są niezbędne do prawidłowego fałdowania białek to izomeraza peptydylowo-prolylowa (peptydyl-prolylisomerase - PPI) i izomeraza dwusiarczków białek (protein disulfide isomerase - PDI).
Hsp70 wiąże się z rozległymi odcinkami nowo syntezowanego polipeptydu, chroniąc powierzchnie hydrofobowe przed przedwczesnym i nieprawidłowym fałdowaniem czy nawet agregacją wielu cząsteczek.
Do uwolnienia białka z kompleksu z Hsp70 wymagana jest energia z cząsteczki ATP, polipeptyd może zostać przekazany do Hsp60 lub uwolnić się do cytozolu.
Wiązanie polipetydu przez Hsp60 pozwala już na jego częściowe fałdowanie. Hsp60 uczestniczy w transporcie polipeptydu do organelli oraz w składaniu białek zbudowanych z wielu podjednostek.
Wyszukiwarka
Podobne podstrony:
CCF20150312�013 (2) Terapio molekularna Kalneksyna jest białkiem związanym z błoną siateczki śródpla
CCF20150312�011 (2) *Terapia molekularna Poznanie patologii molekularnej niektórych chorób dziedzicz
P1520719 Proces przekształcania się sperma tyd w plemniki nazywany jest spermio^enezą Przekształceni
IMGf05 Rybosom jest aparatem molekularnym do wytwarzania polipeptydów: przemieszcza się wzdłuż
Zadaniem terapii zajęciowej w procesie rehabilitacji zajmuje się terapeuta zajęciowy. Celem tych zaj
CCF20110131�006 (2) WYKONANIE ĆWICZENIA Cel ćwiczenia Celem ćwiczenia jest zapoznanie się z procesem
CCF20110312�029 Ta część uziomu, która odprowadza prąd piorunowy nazywana jest użyteczną (graniczną
ccf20110606�006 34. Która postać wirusowego zapalenia wątroby nazywana jest „chorobą brudnych rąk”?
2. Procesy krystalizacji pierwotnej spoin Proces przejścia metalu ze stanu ciekłego w stały nazywamy
ccf20110606�006 34. Która postać wirusowego zapalenia wątroby nazywana jest „chorobą brudnych rąk”?
Jamochłony Ich ciało można porównać do worka, nazywane jest polipem. Do jamochłonów należą
więcej podobnych podstron