Obraz0012
łub
I
I
I
; idzie: p V
- ciśnienie, Ra.
- objętość substancji, m\
- objętość właściwa, mVkg,
(3-Ib)
I
I
I
I
I
I
a
u ilość substancji, kmol,
T • temperatura absolutna. K,
R - uniwersalna stała gazowa (R - 8314,51 ,1/Ckmol/K), R, - indywidualna stała gagowa, J/(kgK), wynika, że dla przemian zamkniętych spełniona jest zależność
f)V “ COnSt ;; pi V j ~ p;V j
(3.2)
ponieważ nRT - • idom,
Ponadto w odniesieniu do przemian izotermie/nyoli otwartych obowiązuje
/alcźność
i
pV - const y- p, V, - p. V. (3.3)
gdzie: V - V/n *■ objętość właściwa molowa, nr/kmoł,
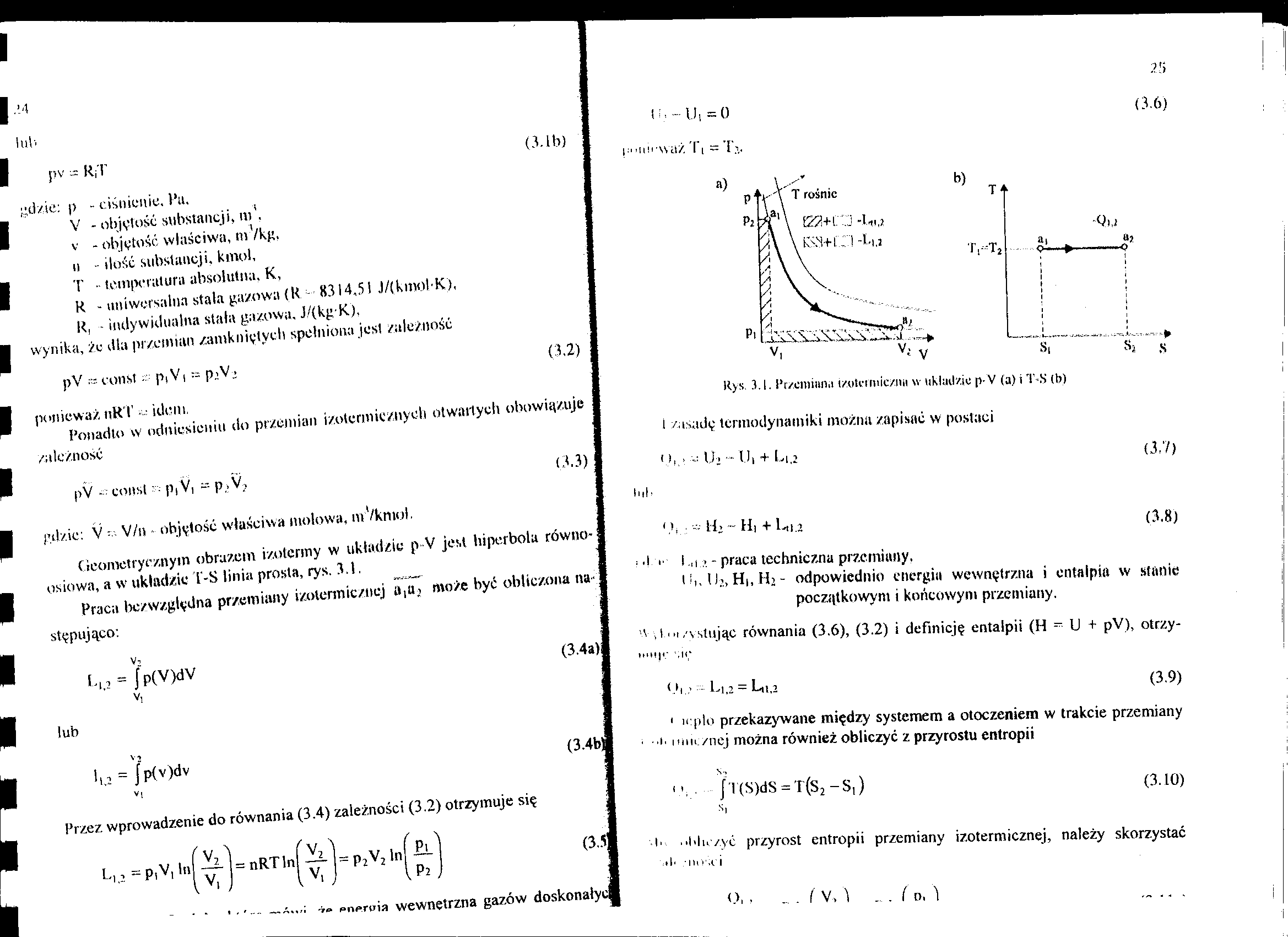
Geometrycznym obrazem izotermy w układzie p V jest hiperbola równo-osiowa, a w układzie T-S linia prosta, rys. 3.1.
Praca bezwzględna przemiany izotermic/nej a,a5 może być obliczona następująco: i
V-j
1.,, = | p(V)dV (3.4a)
v,
lub
il2 = J p(v)dv (3.4b]
VI
Przez wprowadzenie do równania (3.4) zależności (3.2) otrzymuje się L, , =p,V, ln| ^-| = nRTIn| |=p2V2ln
(3,5
Pi
pneraia wewnętrzna gazów doskonałyi
,?<>
= 0
= T
(3.6)
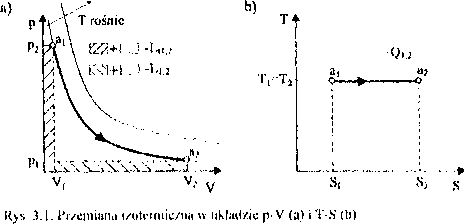
i /asadę termodynamiki można zapisać w postaci
(I,..: U,.....U» + Li.2 <3,7)
mb
n, ^ ~ H, + Ui.z (3.8)
>.I »■ i, > - praca techniczna przemiany.
11,, U2ł Hi, Hi - odpowiednio energia wewnętrzna i entalpia w stanie początkowym i końcowym przemiany.
> t.. >i /yslując równania (3.6), (3.2) i definicję entalpii (H ~ U + pV), Otrzymuj-
Ml - 1-1.2 = Lu.2 (3.9)
< icplo przekazywane między systemem a otoczeniem w trakcie przemiany
• ■ i mic/nej można również obliczyć z przyrostu entropii
S-ł
«y . | l (S)dS = T(S2 -S,) (3.10)
n .'Nu/yć przyrost entropii przemiany izotermicznej, należy skorzystać
• l. iii. i
o, ■ _. t v, \ _. (o, \
Wyszukiwarka
Podobne podstrony:
Scan10022 zapalenie się tej lampki oznacza niski poziom płynu hamulcowego lub zbyt niskie ciśnienie&
skanuj0103 (Kopiowanie) lub w specjalnych opakowaniach ciśnieniowych (aerozolowych). W ty cctatnich
wszystkich kierunkai postaciowych. Objęt lub: Łatwo więc można p pierwotnej objętości .
wszystkich kierunkai postaciowych. Objęt lub: Łatwo więc można p pierwotnej objętości .
21510 PB190013 AMywriośćwsp. n.n. źylm
test z chemii zerowy termin (3) 2. Oblicz ciśnienie w zbiorniku o objętości 1 dnr
105149151210278561651180254196 n r } 30. tylko: CP Fragment danych dotyczy adsorpcji pewnego gazu: 2
Obraz0010 lub entalpię właściwą (wielkość intensywną) *k ł h - U -i- pv (2.8) Po
wszystkich kierunkai postaciowych. Objęt lub: Łatwo więc można p pierwotnej objętości .
DSC04396 m Wentylacja Ciśnieniowa dostarcza stałe ciśnienie I zmienną objętość Wentylacja
samym ciśnieniem, w równych objętościach różnych gazów znajduje się taka sama liczba
Pomiary natężenia przepływu Natężeniem przepływu (lub krótko -przepływem) nazywa się objętość
Obraz (13) zależność ciśnienia od objętości, na oś ciśnienia p. Matematycznie można lo zapisać
wszystkich kierunkai postaciowych. Objęt lub: Łatwo więc można p pierwotnej objętości .
więcej podobnych podstron