1tom305

*s.
Elektrochemia
doc. dr inż. Olimpia Skiba-Rogalska (p. 12.3)
prof. dr hab. Jan Socha (p. 12.2)
mgr inż. Zdzisław Ziętkiewicz (p. 12.1)
12.1. Chemiczne źródła prądu
12.1.1. Wiadomości ogólne
Bezpośrednie magazynowanie energii elektrycznej jest trudne. Proces magazynowania ułatwiają przemiany zarówno energii elektrycznej w energię chemiczną, jak i odwrotnie — energii chemicznej w elektryczną. Umożliwiają to chemiczne źródła prądu, zwane ogniwami galwanicznymi.
I
—CUJ—I
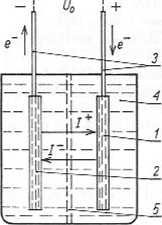
Rys. 12.1. Schemat ogniwa galwanicznego
1 elektroda dodatnia; 2 elektroda ujemna; 3 końcówki elektrod; 4 — elektrolit; 5 — przegroda półprzcpuszczalna; I*, I — prąd jonowy, e~ — prąd elektronowy; U0 — napięcie ogniwa bez obciążenia
Uproszczony schemat ogniwa galwanicznego przedstawia rys. 12.1. Ogniwo to składa się z dwóch elektrod (półogniw) i elektrolitu umieszczonych w naczyniu.
Zapis schematyczny takiego ogniwa jest następujący:
| M2
przy czym: M1, JW2 — substancje czynne (elektrody); z - liczba ładunków elementarnych; | — granica faz pomiędzy elektrodą M, i M2 a roztworem zawierającym jony M 1!' + lu‘5 M2!l+;j — granica zetknięcia dwóch roztworów o różnym składzie.
Na elektrodach w wyniku reakcji przejścia zachodzą procesy redukcji na katodzie i procesy utlenienia na anodzie. Procesowi redukcji towarzyszy pobieranie elektronów, a procesowi utlenienia ich uwalnianie. Opisane reakcje przejścia tworzą parę reakcji utleniania — redukcji, tzw. red-ox. Podstawowym warunkiem redukcji jest elektronoak-ceptorowy charakter substancji elektroaktywncj (ox). W procesie utleniania substancja elektroaktywna (red) ma charakter elektrodonorowy.
Na zanurzonych w elektrolicie elektrodach wytworzy się potencjał Vl i V2 w stosunku do normalnej elektrody wodorowej V„. Pomiędzy elektrodami pojawi się napięcie U0, będące różnicą potencjałów elektrodowych (Ua = V2 — V1).
Połączenie końcówek elektrod z. obwodem zewnętrznym (odbiornikiem) spowoduje przepływ prądu o charakterze elektronowym w elektrodach, ich końcówkach i w obwodzie zewnętrznym, a o charakterze jonowym między elektrodami w elektrolicie.
Rozróżnia się galwaniczne ogniwa pierwotne i wtórne. Ogniwa pierwotne — zwane potocznie bateriami — dostarczają energii elektrycznej w wyniku nieodwracalnych reakcji chemicznych, do momentu zużycia substancji czynnych. Ogniw tych nie można ładować. Ogniwa wtórne — zwane akumulatorami — umożliwiają wielokrotne pobieranie z nich energii elektrycznej po uprzednim naładowaniu z zewnętrznego źródła elektrycznego, dzięki odwracalnym reakcjom chemicznym zachodzącym na elektrodach.
Ogniwa paliwowe stanowią odmianę pierwotnego ogniwa galwanicznego, do którego substancje czynne (paliwo i utleniacz) doprowadza się w sposób ciągły w miarę ich zużycia, przy czym elektrody i elektrolit przeważnie nie zużywają się.
Pojedyncze ogniwa galwaniczne można łączyć szeregowo lub równolegle w baterie. Połączeń równoległych nie zaleca się stosować ze względu na różne właściwości poszczególnych egzemplarzy ogniw.
12.1.2. Baterie galwaniczne (ogniwa pierwotne)
Rozeznanych układów elektrochemicznych stanowiących ogniwa pierwotne jest kilkadziesiąt. W praktyce jednak zastosowano ok. dziesięciu rodzajów baterii galwanicznych (tabl. 12.1). Sumaryczne reakcje prądotwórcze dla wybranych rodzajów baterii przebiegają następująco:
— bateria Leclanchego C|NH4C1, Mn02|Zn
2Mn02 + Zn + 2NH4C1 -- 2MnOOH + Zn(NH3)2Cl2
Tablica 12.1. Rodzaje baterii galwanicznych
|
Nazwa baterii |
Materiał katody |
Elektrolit |
Materiał anody |
Napięcie znamio- |
Wskaźnik energetyczny (praktyczny) |
Temperatura pracy | ||
|
potoczna |
symbol |
V |
mW-h/cm3 |
mW-h/g |
=c | |||
|
Leclanchego |
węgiel (Q. dwutlenek manganu (MnOJ |
chlorek amonu (NH4C1) |
cynk (Zn) |
1,5 |
120-190 |
50—80 |
—10-4- 55 | |
|
Alkaliczna |
L |
C, Mn02 |
wodoro- tlenek potasu (KOH) |
Zn |
1,5 |
200-*-300 |
-a o ■I- 8 |
-29-55 |
|
Powietrzna |
A |
c,o2 |
N1I4C1 |
Zn |
1,4 |
200-1000 |
300-380 |
-20-7-55 |
|
Rtęciowa |
M |
tlenek rtęci (HgO) |
KOH |
Zn |
1,35 |
400 - 500 |
90-120 |
•n T o 7 |
|
Srebrowa |
S |
tlenek srebra (Ag2ó) |
KOH |
Zn |
1,55 |
550 -650 |
90-150 |
i o •I- UA CA |
|
Mangano- wo-litowa |
c |
Mn02 |
organiczny |
Li |
3,0 |
360 - 500 |
80+150 |
-55 + 75(90) |
|
Tionylowo- •litowa |
E |
chlorek tio-nylu ($OCl2) |
organiczny |
Li |
3,6 |
450 - 500 |
400 |
-55-75 (90) |
Wyszukiwarka
Podobne podstrony:
1tom Autorzy doc. dr hab. Jan Witold Baran doc. dr Krystyna Bieńkowska-Lipińska prof. dr inż. Stanis
2tom268 Trakcja elektryczna doc. dr inż. Franciszek Kolarski prof dr inż. Ryszard Matusiak7.1. Wiado
Doc. dr hab. inż. STANISŁAW SERKOWSKI Politechnika Śląska Katedra Nauki o MateriałachOPTYMALIZACJA
skanowanie0016 2 Politechnika Wrocławska dr inż. Marian HOPEJ doc. dr hab. Jerzy WILIMOWSK!Stopień d
doc. dr hab. inż. AlojzySPICHALSKI* 5.03.1909 ■5= 22.01.1977docent Politechniki Gdańskiej, kierownik
2 Recenzenci: prof. dr hab. inż. Ludosław Drelichowski prof. dr hab. Andrzej Straszak doc. dr h
32 156# Śródmieścia naszych miast* Rozmowa z doc# dr hab# inż# arch# Stanisławem Juchnowiczem,
doc. dr hab. Hanna Kunachowicz, dr Irena Nadolna, inż. Krystyna Iwanow, mgr inż. Beata PrzygodaWarto
_198J> Nr kol. 661 ZBSZYTY SAUKOWE POLITECHNIKI ŚLĄSKIEJ Seria: ELEKTRYKA z. 100 Dr hab. inż. Les
1tom001 Opiniodawcy I wydania doc. dr hab. Antoni Adamczyk (rozdz. i), prof. dr hab. inż. Jacek Czaj
WŁADZE WYDZIAŁOWE WYDZIAŁ ELEKTROTECHNIKI I AUTOMATYKIDziekan dr hab. inż. Leon Swędrowski prof. nad
DSC01094 Doc. dr hab. ini. JERZY KOBIAK Prof. dr Hab. inż. WIESŁAW STACHURSKIKONSTRUKCJEŻELBETOWE wy
Podstawy Elektroniki iMiernictwa dr hab. inż. Janusz Martan (pok. 4.17 B4, tel. 320-4221) Wrocław 20
135 naukowo-dydaktycznej Zakładu dołączył doc. dr hab. inż. Tadeusz Glinka oraz doc. kontr, dr inż.
116 34. MET Andrzej Metody minimalizacji błędów trans- doc. dr hab. inż.
124 11. CZARNECKI Leszek Synteza modelu przekształcenia Hilberta doc. dr hab. inz.
Doc. dr hab. inż. Zbigniew Zieliński - wspomnienie W dniu 16 maja 2003 roku zmarł nagle w Krakowie d
23 Rys historyczny Wydziału promotorem był doc.dr hab. inż. Jerzy Krzemiński. Następne obrony prac
więcej podobnych podstron