40 4
1
2 WIĄZANIA MII;OZY ATOMAMI
1
2.6. Energia wiązań między atomami
nr-sciagania si< jonó* przeciwnie W wiąraniach jonowych sih ^^kl^lycmcgo przyciągania mc ładun naładowanych jest po prosiu iw > ^ moie być wyrażona zulO.noSc.it

międz> jonami
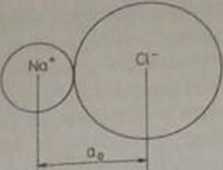
Zależność siły przyciągania elektrostatycznego od odległości międ/> jonami w przypadku jonów Na * i Cl przedstawiono na rys. 2.12. Wynika z niego, że siła przyciągania elektrostatycznego wzrasta bardzo szybko, gdy odległość międzs jonami (a) maleje. W miarę zbliżania się jonów do siebie pod wpływem siły przyciągania elektrostatycznego zaczyna działać siła odpychająca {FJ. Powstała ona w wyniku nakładania się powłok elektronowych poszczególnych jonów ora/ odpychania się dodatnio naładowanych jąder. Zależność siły odpychającej (Fa) ora/ wypadkowej siły oddziaływania (F = Ft + FJ, w przypadku pary jonów przeciwnie naładowanych, od odległości między jonami pokazano na rys. 2.13. Równowagow a odległość między jonami (aj jest określona równowagą sił przyciągania i odpychania (Ft -f F9 = 0). Z rysunku 2.13 widać, że aby zmniejszyć odległość między jonam poniżej av. najeży przyłożyć siłę ściskającą, natomiast aby ją zwiększyć - siłę rozciągającą. Duże zmiany siły F z odległością a w pobliżu a, są typowe dl; materiałów o dużej sztywności.
Między energią oddziaływania pomiędzy jonami (E) i siłą oddziaływania (r) występuje zależność
da
3-
jonami wynosi 0.28 run

0
/
\ Wypodkowo sła wiązania F
SHa przyciągająca

,'-QŁ 06 a.rm
/
/*'"• S»to odpychająca F,
RYS.2.13. Wypadkowa sili wiązań między par* jonów Na * .Cl Rfiwnowagow. odkgtód nucdzy
WynikajKO) stąd z kolei zależność energii oddziaływania od odległości między jonami pokazano na rys. 2.14. Równowagowej odległości między jonami odpowiada minimum energii oddziaływań, nazywane energiij wiązania, zatem do tego. aby przemieścić jony z położenia równowagi, konieczne jest dostarczenie energii.
Zależność energii oddziaływań między atomami od odległości a dla pozostałych typów wiązań jest jakościowo podobna. Duże różnice występują natomiast w energii wiązań (tabl. 2.4). Energia wiązań van der Waałsa jest większa w przypadku dipoli trwałych. Przykładowo w argonie (dipole chwilowe) wynosi 0,99 kJ-mol"1, natomiast w H20 (dipole trwałe) wynosi 21 kJ-mol-1.
TABLICA 2.4. Energia różnych typów wiązań
Energia wiązania kJ mol ‘1
Jonowe Kowalencyjne Metaliczne Van der Waalsa
600-1550
500-1250
100-850
<40
41
Wyszukiwarka
Podobne podstrony:
4 (887) 2008-12-19 Przykład związków kowalencyjnych Energia wiązania • Między atomami
Energia wiązań między atomami Tablica 2.7 Energia wiązań między atomami tv różnych substancjach
IMGe90 [slajdy] Wiązania między atomami w materiałach ceramicznych
skanuj0028 -rodzaj wiązanki między atomami -konfiguracja elektronów -struktura sieci
Podstawy nauki o materiałach Rodzaje wiązań między atomami w materiałachKowalencyjne Techniczne
Rodzaje wiązań między atomami występującymi w podstawowych grupach materiałów
zagadnienia z biofizyki elektryka[1] I Budowa materii a) wiązania między atomami. •» wiązania międz
img063 (12) inne amidy kwasowe ma charakter polarny, co jest przyczyną tworzenia się podwójnego wiąz
Wiązania międzyatomowe Typ wiązania Energia (kJ/mol) Jonowe (np.. Ną+CI-, kierunkowe,
DSC06737 RODZAJE WIĄZAŃ CHEMICZNYCH
DSC06738 RODZAJE WIĄZAŃ CHEMICZNYCH
Wiązania między atomami Jonowe: para elektronów w całości przyłączana przez anion Atomowe
Rysunek 2.5 Rodzaje wiązań między atomami występującymi w podstawowych grupach materiałów
35373 IMGC42 [slajdy] Rzeczywisty kształt polimerów Ze względu na naturę wiązań między atomami węgla
więcej podobnych podstron