64 2

Zasada Schiffa łącząca substrat - aminokwas i PLP stanowi aldoiminę zewnętrzną. W wyniku utraty protonu przy węglu a tworzy ona produkt pośredni - chonoid, który ulega protonacji dając ketoiminę. W ketoiminie wiązanie podwójne występuję między N a Ca w substracie, natomiast w aldoiminie - między N i węglem karboksylowym PLP. Ketoimina ulega następnie hydrolizie do a-ketokwasu i fosforanu pirydoksaminy. Etapy te stanowią połowę reakcji transaminacji:
aminokwas! + E-PLP <--> a-ketokwaSi + E-PMP
Druga część reakcji jest odwróceniem pierwszej. Kolejny a-ketokwas reaguje z kompleksem enzym - fosforan pirydoksalu ( E - PLP ).
a-ketokwas2 + E-PMP > aminokwas2 + E-PLP
Po zsumowaniu reakcji cząstkowych otrzymujemy: aminokwas! + a-ketokwas2<--> aminokwas2+ a-ketokwaSi
Transaminacji mnie podlegają:
• lizyna
• treonina
• prolina
• hydroksyprolina
40. Dekarbokslacia aminokwasów - synteza amin biogennych Przebiega według przedstawionego poniżej schematu w tkankach:
RCH(NH2)COOH -» dekarboksylaza RCH2NH2+ C02
Grupą prostetyczną enzymów uczestniczących w procesach dekarboksylacji jest fosforan pirydoksalu, który tworząc kompleksy ze specyficznymi białkami daje początek wszystkim dekarboksylazom L - aminokwasów. Produktami reakcji dekarboksylacji aminokwasów są aminy zwane biogennymi. Przykłady:

Dekarboksylacja histydyny do histaminy przy udziale dekarboksylazy histydynowej. Histamina wspomaga pracę gruczołów wydzielania wewnętrznego i obniża ciśnienie krwi.

Dekarboksylacja tryptofanu do tryptaminy przy udziale dekarboksylazy tryptofanowej. Tryptamina łatwo przechodzi w serotoninę.
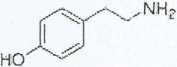
Dekarboksylacja tyrozyny prowadzi do utworzenia tyraminy.
64
Wyszukiwarka
Podobne podstrony:
Zasada niezamykania łańcuchów wymiarowych Łańcuchy wymiarowe stanowią szereg kolejnych wymiarów
Slajd72 Druga zasada termodynamiki w procesachbiologicznych 0 Entropia organizmu żywego, stanowiąceg
64 65 (20) 64 URAZY I USZKODZENIA SPORTOWE Dużą pomoc diagnostyczną stanowią testy umożliwiające wyk
Około 64% całego terytorjum sowieckiego Sachalinu <2,8 milj. ha) stanowi;} lasy. Lasy te w 4
DSC05344 (3) Punkt centralny, łączący poszczególne tory metaboliczne, stanowi cykl Krebsa Kluczowym
Zasada inconipabilitas: zakaz łączenia mandatu parlamentarnego i stanowiska w rządzie: Szwajcaria US
Budowa aminokwasów ■ Wyjątek stanowi glicyna (Gly), której podstawnik (R)
Testy oddechowe • Zasada testu oddechowego: substrat > badane enzymy lub funkcj
więcej podobnych podstron