arkusz2 1

TECHNOLOGIA CHEMICZNA - SEMESTR IV
ARKUSZ II
KONDUKTOMETRIA
Roztwory elektrolitów przewodzą prąd elektryczny, są więc przewodnikami. Należą one do grupy przewodników jonowych, w których nośnikami ładunku są jony obdarzone masą, a przepływowi prądu towarzyszy przenoszenie masy i zajście reakcji chemicznych na elektrodach (elektroliza), jeśli stosowany jest prąd stały. Przewodzenie prądu opisane jest prawami Ohma :
I prawo Ohma U = I R
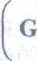

II prawo Ohma R =

gdzie : U - napięcie ; I - natężenie prądu ; R - opór ; G - przewodnictwo (jednostka Siemens S = O1) ; p - opór właściwy ; I - długość przewodnika ; A - pole przekroju poprzecznego przewodnika, prostopadłego do kierunku przepływu prądu
Podstawową wielkością charakteryzującą zdolność roztworów elektrolitów do przewodzenia prądu jest przewodnictwo właściwe k :
1 1 ł r 1
p R A A
Przewodnictwo właściwe to przewodnictwo roztworu elektrolitu zawartego pomiędzy elektrodami odległymi o jednostkę (1 m) i polu przekroju poprzecznego jednostkowym (lm2). Jednostką przewodnictwa właściwego jest śtW lub Sm'1. Przewodnictwo właściwe rośnie silnie wraz ze wzrostem temperatury. Przewodnictwo właściwe roztworów elektrolitów mierzone jest przy użyciu zmodyfikowanego mostka Wheatstone’a w sposób porównawczy czyli przewodnictwo właściwe badanego roztworu jest porównywane z przewodnictwem właściwym wzorca (zwykle roztworu K.C1).
K ^ k Kwz ^ HZ
=> Kx —
gdzie : k - stała naczyńka konduktometrycznego
Przewodnictwo właściwe rośnie wraz ze wzrostem stężenia elektrolitu. Aby porównać przewodnictwa różnych elektrolitów niezależnie od ich stężenia wprowadzono przewodnictwo molowe A. Przewodnictwo molowe roztworu elektrolitu to przewodnictwo roztworu elektrolitu zawartego pomiędzy elektrodami odległymi o jednostkę (1 m) i o takiej powierzchni, że w tak utworzonej objętości zawarty jest 1 mol elektrolitu. Jednostką przewodnictwa molowego jest Q’1m‘mor1 lub Sm2moł l. Przewodnictwo molowe obliczamy ze wzoru :
A = —
c
gdzie : c - stężenie molowe (wyrażone w mol/m3J
Przewodnictwo molowe zależy od stężenia, maleje wraz ze wzrostem stężenia. Dla elektrolitów mocnych (całkowicie zdysocjowanych na jony przy dowolnym stężeniu) zależność ta opisana jest wzorem Kohlrauscha :
A = A0-bVc słuszne dla c < 0,01 mol/dm3
gdzie : b - stała ; A0 - graniczne przewodnictwo molowe
Graniczne przewodnictwo molowe jest to przewodnictwo molowe roztworu w rozcieńczeniu nieskończenie wielkim (przy stężeniu dążącym do zera). Można je wyznaczyć przez ekstrapolację zależności A = f(Vc) do zera (tylko dla elektrolitów mocnych). Dla elektrolitów słabych, które są częściowo zdysocjowane na jony, a stopień dysocjacji rośnie wraz ze spadkiem stężenia, dążąc do jedności w rozcieńczeniu nieskończenie wielkim, wzór Kohlrauscha nie
Wyszukiwarka
Podobne podstrony:
arkusz3 1 TECHNOLOGIA CHEMICZNA - SEMESTR IV ARKUSZ III POTENCJOM ETRIA Półogniwo to układ złoż
arkusz4 1 TECHNOLOGIA CHEMICZNA - SEMESTR IV ARKUSZ IVKINETYKA CHEMICZNA Szybkość reakcji chemicznej
Scan126 12. ROZTWORY ELEKTROLITÓW.PRZEWODNICTWO ELEKTROLITYCZNE. OGNIWA Potencja! chemiczny, fi, sol
Technologia Informacyjna semestr I, studia stacjonarne I stopnia Elektronika i Telekomunikacja
POLITECHNIKA POZNAŃSKA WYDZIAŁ TECHNOLOGII CHEMICZNEJ Instytut Chemii i Elektrochemii Technicznej
Chemia fizyczna - kierunek technologia chemicznaHarmonogram laboratorium dla II roku w semestrze zim
216 Veniam legendi z zakresu technologji chemicznej i elektro-chemji technicznej na Wydziale Chemicz
Struktura Wydziału Technologii ChemicznejInstytut Chemii i Elektrochemii Technicznej 1.
CzP7 30 Technologia chemiczna surowce... - seminarium Semestr letni 2012/2013 Czwartek TP godz. 7:30
Rok II. Przedmioty wspólne - Technologia chemiczna/Inżynieria materiałowa Semestr III__ w ć s I p
Technologia i urządzenia obróbki cieplno-chemicznej Semestr Rodzaj zajęć Liczba godzin
Semestr I Technologia Chemiczna i Kataliza Nazwa przedmiotu Rodzaj Liczba godz w
Semestr 1 Technologia Chemiczna i Kataliza Nazwa przedmiotu Rodzaj Liczba godz w
Technologia Chemiczna i Kataliza Semestr II Nazwa przedmiotu Rodzaj Liczba godzin zajęć w
Semestr I Technologia Chemiczna i Kataliza Nazwa przedmiotu Rodzaj Liczba godz w
Semestr 1 Technologia Chemiczna i Kataliza Nazwa przedmiotu Rodzaj Liczba godz w
Semestr 1 Technologia Chemiczna i Kataliza Nazwa przedmiotu Rodzaj Liczba godz w
Semestr 1 Technologia Chemiczna i Kataliza Nazwa przedmiotu Rodzaj Liczba godz w
więcej podobnych podstron