Scan126

12. ROZTWORY ELEKTROLITÓW.
PRZEWODNICTWO ELEKTROLITYCZNE. OGNIWA
Potencja! chemiczny, fi, soli w roztworze, w którym dysocjuje ona na jonów dodatnich i vJonów ujemnych:
soli V-soli ^
^soli =V4-JX+ +V_|X_
\lsolj = v + p.° 4- RTlnaZ' +v_|.l° + RTlna*-
V * V_
“son •«-
<3+=Y+m+;
gdzie a jest aktywnością, y - współczynnikiem aktywności, a m- stężeniem w niolacłi/kg rozpuszczalnika. Indeksy: "+ " i " oznaczają odpowiednio kation i anion.
Średni molowy współczynnik aktywności soli:
y± =v*łvAv+- •Tl- •
Graniczne prawo Debye’a - Hueckela:
lgy± = ~a\z+
gdzie /< jest stalą charakteryzującą rozpuszczalnik^ zależną od T\ I jest silą jonową roztworu:
/ i
gdzie mt jest stężaniem danego jonu w molach/kg rozpuszczalnika, a z, - jego liczbą ładunkową. Oporność (rezystancja) roztworu:
a ,
A K
gdzie / jest grubością warstwy roztworu, A- powierzchnią przekroju , a te - jego przewodnictwem właściwym (Q'' m'1).
Przewodnictwo molowe:
A
mol
IOOOk
c
gdzie c jest stężeniem w molach/dm3 roztwoni.
Prawa Kohlrauscha:
• W przypadku elektrolitów mocnych w rozcieńczonych roztworach:
Amoi — A°°moi- Kc1/2,
gdzie A°°mai jest przewodnictwem molowym w rozcieńczeniu nieskończenie dużym, a K - stałą zaieżną przede wszystkim od typu elektrolitu (stosunek wartościowości kationu do anionu).
* Prawo niezależnej wędrówki jonów:
VDO O Ł*n A OO
mol ^ +'v +■ ^ -ł
gdzie 7C“ + i X". oznaczają przewodnictwo molowe kationu i anionu w rozcieńczeniu nieskończenie dużym.
K E ’ “ E ’
gdzie u,. i u. są, odpowiednio, ruchliwościami kationu i anionu, a u,, i x>. - ich prędkościami w polu elektrostatycznym o natężeniu K
h ~ Fnh
gdzie f jest stalą Faradaya.
Siła elektromotoryczna ogniwa:
E = E° +
rt . nav/
-t— ln —■ -
\¥ na';
gdzie lA jest standardową silą elektromotoiyczną danego ogniwa, ax i ap - aktywnością substratów i produktów reakcji przebiegającej w ogniwie, vv i vp - współczynnikami siechiorne-tiycznymi w równaniu reakcji, a z - liczbą elektronów, wymienianych podczas reakcji. AG, AHi AS reakcji przebiegającej w ogniwie:
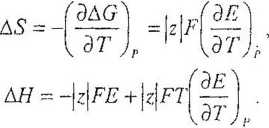
AG = -|z|F£; AG0 = -|z|rE°,
12.1. Zadania
12.1. W teorii Dębye’a - Hueckela zakłada się, że przyczyną odstępstw od modelu roztworów doskonale rozcieńczonych są oddziaływania między: a) jonami, b) cząsteczkami rozpuszczalnika, c) jonami i cząsteczkami rozpuszczalnika.
12.2. Czy można eksperymentalnie wyznaczyć bezpośrednio aktywności osobno kationów, osobno anionów? a) Tak, b) nic.
12.3. Czy można wyznaczyć średni molowy współczynnik aktywności soli w roztworze, y+ metodą eksperymentalną? a) Tak, b) nie.
12.4. W zakresie niskich stężeń roztworów elektrolitów współczynniki aktywności ...................jonów w roztworze............... przy wzroście siły jonowej
roztworu (uzupełnić: wszystkich, niektórych, rosną, maleją nie zmieniają sic).
Wyszukiwarka
Podobne podstrony:
hpqscan0007 Podstawy chemii fizycznej 42. Siła elektromotoryczna ogniwa jest to: f różnica potencjał
0000016 (18) wzorem 4.44. w którym fi oznacza siłę elektromotoryczną ogniwa równą potencjałowi redox
Potencjał elektrochemiczny - różnica potencjału na granicy faz metal/roztwór. W układach metal/roztw
1tom163 6. ELEKTROTECHNIKA TEORETYCZNA 3286.12.4. Fala płaska w przewodniku W tablicy 6.28 zestawion
1tom316 12. ELEKTROCHEMIA 634 Elektrodami ogniwa korozyjnego mogą też być różne metale stykające się
Scan133 142 12.63. elektrony, b. 12.64. różnicę potencjałów;
W ogniwie galwanicznym siła elektromotoryczna ogniwa jest różnicą standardowych potencjałów
364 [1024x768] OGNIWA GALWANICZNE Klucz elektrolityczny eliminuje potencjał dyfuzyjny, występujący n
Potencjał dyfuzyjny dodaje się do siły elektromotorycznej ogniwa tak jak by to były dwa szeregowo po
DSCN4170 (4) Ogniwo elektrochemiczneOgniwo elektrochemiczne Różnicę potencjałów nie pracującego ogni
DSCN4171 (4) Siła elektromotoryczna ogniwa E - F° ox/red Sw/rcd +nF c , red roztwory silnie
więcej podobnych podstron