CCF20100601�010

NADPRODUKCJA I OCZYSZCZANIE REKOMBINOWANYCH. HETEROLOGICZNYCH BIAŁEK 93
NADPRODUKCJA I OCZYSZCZANIE REKOMBINOWANYCH. HETEROLOGICZNYCH BIAŁEK 93
II
LB + IPTG
III
membrana

IV
filtr
membrana bibuła 3M
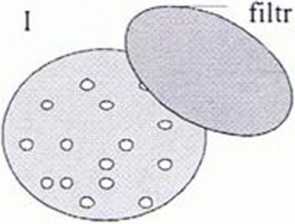
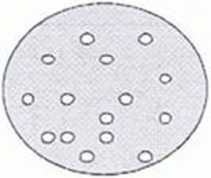
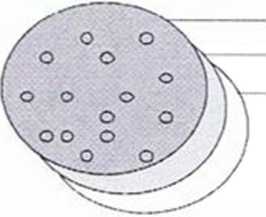
Rys. 2. Filtracja kolonijna
Komórki zawierające różne warianty konstruktów do ekspresji są wysiewane na podłożu LB (I). Na powierzchni kolonii umieszczany jest filtr membranowy. Kolonie przylegają do niego i mogą być oderwane od podłoża. Ekspresja białka jest indukowana poprzez umieszczenie filtru na szalce z podłożem LB zawierającym IPTG (II). Następnie komórki są poddawane lizie. a białka rozpuszczalne dyfundują poprzez filtr do membrany nitrocelulozowej, podczas gdy ciała inkluzyjne pozostają na filtrze (III). Kolonie eksprymujące rozpuszczalne białko mogą być zidentyfikowane na membranie nitrocelulozowej za pomocą standardowych metod immunologicznych (IV).
w formie rozpuszczalnej. Na N-końcu rekombinowa-nego białka dołączony jest jeszcze dodatkowo znacznik His6, umożliwiający oczyszczanie białka w standardowych warunkach metodą chromatografii powinowactwa na jednym typie złoża.
Jeżeli pierwsza pula konstruktów nie da oczekiwanych rezultatów, rozwiązaniem może być zastosowanie innych, rzadziej używanych znaczników. Może być to Z-tag (tzw. domena Z z Staphylococcus sp., pET22-la), GB 1-Tag (domena pi białka G z Streptococcus sp., pHISGBl) czy białko NusA.
Bardzo istotnym elementem eksperymentów' nadprodukcji białek jest opracowanie metodyki przeszukiwania (tzw. screening), czyli szybkiego i nie wymagającego dużych nakładów czasu na sprawdzenie, który z konstruktów' jest optymalny do oczyszczania białka na dużą skalę. Jednym z najczęściej stosowanych sposobów jest elektroforeza w żelu poliakry-lamidowym (SDS-PAGE). Na żelu rozdziela się najczęściej białka pochodzące z rozpuszczalnej frakcji lizana komórek z małej ilości hodowli; stosowane jest też wstępne oczyszczenie na małej ilości złoża.
Metodę tą można, ze względu na koszty i czas, zastosować tylko do pewnej liczby prób [10]. Alternatywną metodą jest tzw. filtracja kolonijna (colony filtration, Co-Fi). Ta technika nie wymaga przygotowywania lizatów z hodowli, obecność rozpuszczalnego białka można stwierdzić już na poziomie kolonii, co umożliwia przeszukanie znacząco większej liczby konstruktów. Szczegóły metody są pokazane na rys. 2.
3. Podsumowanie
Od końca poprzedniego wieku wyraźnie zauważamy zmianę strategii analizy procesów genetycznych. Punkt ciężkości przesuwa się z badania pojedynczych genów czy operonów w kierunku globalnych analiz komórek zarówno pro-jak i eukariotycznych. Dodatkowo w ostatnich latach coraz więcej uwagi poświęcamy nie analizom genów czy transkryptów (genomika, trans-kryptomika) a analizom białek i ich oddziaływań (proteomika, interaktomika). Tylko niewiele białek wy-stępuję w komórkach naturalnych gospodarzy w dostatecznie dużej ilości aby móc je oczyszczać do badań funkcjonalnych lub/i strukturalnych. W ostatnich latach opracowano wiele nowych strategii pozwalających na
Tabela VI
Najczęściej napotykane problemy i ich możliwe rozwiązania w eksperymentach nadekspresji białek w komórkach E. coli.
Sporządzono na podstawie [23, 30, 41]
|
Problem |
Możliwa przyczyna |
Rozwiązania |
|
Śmierć komórek, brak kolonii |
Białko toksyczne, zbyt wysoki poziom ekspresji |
Silniejsza kontrola ekspresji podstawowej Słabszy promotor. Niższa temperatura Mniejsze stężenie induktora |
|
Białko w ciałach inkluzyjnych |
Zbyt wysoki poziom ekspresji |
Słabszy promotor. Niższa temperatura Mniejsze stężenie induktora Plazmid o niższej liczbie kopii Dołączenie hydrofilowego znacznika |
|
Brak ekspresji, eksprymowane tylko fragmenty białka |
Problem używalności kodonów |
Zastosowanie gospodarza dostarczającego rzadkie tRNA. Niższa temperatura |
|
Białko nie jest transportowane do pcryplazmy |
Sekwencja sygnalna nie rozpoznawana w E. coli Zbyt mało wydajne mechanizmy translokacji |
Dołączenie innej sekwencji sygnalnej bądź znacznika. Koekspresja genów sec |
|
Brak ekspresji |
Proteoliza (szczególnie w przypadku białek mniejszych niż 10 kDa) Mutacje wprowadzające kodon stop wewnątrz sekwencji kodującej genu |
Niższa temperatura. Krótszy czas indukcji Dołączenie znacznika. Sekwencjonowanie |
Wyszukiwarka
Podobne podstrony:
CCF20100601�002 NADPRODUKCJA I OCZYSZCZANIE REKOMB1NOWANYCH. HETEROLOGICZNYCH BIAŁEK 851.2. Wektor1.
CCF20100601�004 NADPRODUKCJA I OCZYSZCZANIE REKOMBIKOWANYCH, HETEROLOGICZNYCH BIAŁEK 87 na tym model
CCF20100601�006 NADPRODUKCJA I OCZYSZCZANIE REKOMBINOWANYCH, HETEROLOGICZNYCH BIAŁEK 89 NADPRODUKCJA
CCF20100601�008 NADPRODUKCJA I OCZYSZCZANIE REKOMBINOWANYCH, HETEROLOGICZNYCH BIAŁEK 91 obecne jedyn
CCF20100109�027 ® ŚRODKI ŚCIĄGAJĄCE - POWODUJĄ DENATURACJĘ BIAŁEK I ŚLUZU NA POWIERZCHNI BŁONY&
CCF20111010�023 7.3. Produkty przemysłowe: proces opracowywania białek serwatkowych... 349 zbierać n
CCF20131128�090 IX. Określanie typu budowy ciała 93 Tabela 38. Ocena typu budowy ciała studenta I ro
CCF20100601�000 POST. MIKROBIOL.. 2008. 47, 2. 83-95 http://www.pm.microbiology.pl NADPRODUKCJA I OC
CCF20111206�026 (Kopiowanie) nadprogramowe. Planowano, że właśnie w szkole rozpocznie się wdrażanie
img002 (93) g * nadproża żelbetowe prefabrykowane D
CCF20121026�002 Ćwiczenie 6 Temat: Oczyszczanie białek metodą dializy. Zastosowanie chromatografii d
SL275403 Białka sarkoplazmatyczne Grupa białek heterogennych Rozpuszczalne w wodzie, lub w roztworac
img003 (97) Ui.0 Rozwiązania nadproży Przekrój; pionowy zewnętrznej ściany szczelinowej w poziomie n
skanuj0076 (15) 75Rodzaje ścian i materiały ścienne prefabrykowana belka nadprożowa zwykła
IMG&06 Tuberkulina oczyszczona mieszanina białek prątków - PPD (purified protein deriyate) Służy do
więcej podobnych podstron