CCI20111111�026

2. PRĄD W ELEKTROLITACH
2.1. Działanie chemiczne prądu elektrycznego
Z kursu fizyki przypominamy, że w roztworach kwasów, zasad i soli występuje zjawisko dysocjacji elektrolitycznej. Polega ono na rozpadaniu się cząsteczek kwasów, zasad lub soli pod wpływem rozpuszczalnika na jony dodatnie i ujemne. W elektrolitach jonami dodatnimi są jony wodoru i metali, jonami ujemnymi pozostałe resztki cząsteczek substancji rozpuszczonej (reszta kwasowa lub grupa wodorotlenowa).
Jeśli w elektrolicie zanurzymy dwie płyty, zwane elektrodami, i połączymy je z biegunami źródła energii elektrycznej (rys. 2-1), to w elektrolicie pod wpływem wytworzonego pola elektrycznego
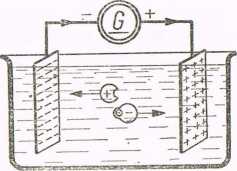
Rys. 2-1. Przepływ prądu elektrycznego przez elektrolit
rozpocznie się uporządkowany ruch jonów, przy czym jony dodatnie będą się poruszały w kierunku do elektrody połączonej z biegunem ujemnym źródła energii, zwanej katodą (dlatego też jony dodatnie nazywamy kationami), jony zaś ujemne — do elektrody połączonej z biegunem dodatnim, zwanej anodą (jony ujemne nazywamy anionami). Jony ujemne po osiągnięciu anody oddają jej swoje nadmierne elektrony stając się cząsteczkami obojętnymi. Oddane anodzie elektrony węcLrują po przewodzie i przez źródło ener-
gii dostają się do katody. Jony dodatnie po osiągnięciu katody pobierają z niej brakujące im elektrony i stają się obojętnymi cząsteczkami.
W ten sposób powstaje w obwodzie przepływ prądu elektrycznego, który w elektrolicie polega na uporządkowanym ruchu jonów, prąd taki nazywamy prądem jonowym. Prąd ten powoduje rozkład chemiczny elektrolitu — zjawisko to nazywamy elektrolizą.
Prąd ten podlega prawu Ohma, czyli I = gdzie R jest opo-
h,
rem elektrolitu. Zależy on od liczby jonów zawartych w 1 cm3 elektrolitu i od stężenia elektrolitu.
Im mniejsze jest stężenie elektrolitu, tym większy jest stopień dysocjacji elektrolitycznej i tym większa stosunkowo liczba cząsteczek substancji rozpuszczonej rozpada się na jony. Ale z drugiej strony zmniejszenie stężenia prowadzi do obniżenia liczby cząsteczek w 1 cm3 substancji, wobec tego ze wzrostem stężenia opór właściwy początkowo maleje i przy pewnej wartości stężenia osiąga minimum, przy dalszym wzroście stężenia — wzrasta.
Masę substancji wydzielonej na elektrodzie podczas przebiegu elektrolizy określa pierwsze prawo Faradaya, a mianowicie: masa substancji wydzielonej na elektrodzie podczas przepływu prądu elektrycznego jest wprost proporcjonalna do natężenia prądu i do czasu trwania elektrolizy
m = kit (2-1)
gdzie: m — masa wydzielona na elektrodzie w gramach, I — natężenie prądu w amperach, t — czas w sekundach, k — współczynnik proporcjonalności, zwany równoważnikiem elektrochemicznym wydzielonego pierwiastka.
Zakładając we wzorze (2-1) I = 1 A, t = 1 s, otrzymamy k — —; k — m,
a zatem równoważnik elektrochemiczny jest masą substancji wydzielonej podczas elektrolizy przy przepływie prądu o natężeniu 1 ampera w ciągu 1 sekundy, czyli przy przepływie ładunku elektrycznego o wartości jednego kulomba.
53
Wyszukiwarka
Podobne podstrony:
ENERGIA Przesyłanie prądu Prąd elektryczny zanim dopłynie z elektrowni do naszego domu, pokonuje dł
energia Przesyłanie prądu Prąd elektryczny zanim dopłynie z elektrowni do naszego domu, pokonuje dłu
fizykoterapia 2 - CZYNNIKI ELEKTROCHEMICZNE Bodźcem jest prąd elektryczny, który powoduje zmian
Wielkości charakteryzujące prąd elektryczny Natężenie prądu - stosunek wartości ładunku do czasu, w
31 (508) Elektromagnetyzm dem. Na przewodnik, przez który płynie prąd o natężeniu / działa siła elek
10863914?5236512872842!22044122308488333 o Prąd elektryczny Prąd elektryczny to uporządkowany ruch ł
wytwarzają one prąd elektryczny w momencie działania naprężeń mechanicznych. Omówioną właściwość
3. Charakterystyka prądu elektrycznego • Prąd elektryczny w metalach to ukierunkow
1. Wprowadzenie - rozmowa z pięciolatkami na temat prądu elektrycznego Co to jest prąd elektryc
DSCI2415 Elektrosta ty ka: F = k • q ^ - Prawo Columba [N]Prąd Elektryczny: W U =--wzór na napięcie
DSC00418 Prąd elektryczny - uporządkowany (skierowany) ruch ładunków elektrycznych. Przyczyną prądu
Image19 (29) A.1, Wpływ prądu zmiennego 50 Hz na pracę serca Prąd elektryczny przepływając przez ser
Prąd elektryczny 1.1.Pojęcie prądu elektrycznego Prądem elektrycznym nazywamy uporządkowany ruch
Jak to działa Przepływ prądu przez cewkę elektromagnesu wywołuje pole magnetyczne. Wciąga ono
więcej podobnych podstron