img324 2

191
granicy ziarna jest większa niż w samym ziarnie. Niejednorodność wnętrza ujawnia ;:ę w skali mikro również na powierzchni metalu. W środowisku elektrolitu zachodzi selektywne zniszczenie w mikroogniwach korozyjnych, w którym granice ziaren ziają się obszarem anodowym, a obszar ziarna mający niższą energię obszarem katodowym. Anodą w tym układzie może być:
- metal, składnik stopu, o niższej wartości potencjału standardowego, np. cynk w mosiądzu;
- żelazo w przypadku stali węglowych i żeliwa. Katodę w tym układzie stanowią wtrącenia niemetaliczne, np. węglik żelaza (Fe3C) w stali, grafit w żeliwie szarym czy inne tlenki bądź siarczki.
W budownictwie powszechnie wykorzystywane są stopy żelaza z węglem, który wstępuje w postaci wolnej jako grafit lub w postaci związku chemicznego - węglika żelaza (Fe3C) o nazwie cementyt. W zależności od rodzaju stopu ilość węgla zawiera się w przedziałach: 0,2-2,1% w przypadku zwykłych stali węglowych oraz 2.1-3,6% dla żeliw. Ponadto stale mogą zawierać modyfikatory właściwości w postaci dodatków stopowych, takich jak chrom czy nikiel, oraz domieszek innych pier-■ :astków pochodzących z procesu metalurgicznego.
Na powierzchni stopu w bezpośrednim kontakcie znajdują się więc obszary o różnym składzie chemicznym, które w zetknięciu z roztworem elektrolitu przyjmują różne ' lencjały. W ten sposób powstaje niezliczona ilość mikroogniw, w których potencjał standardowy ogniwa Fe/Fe2+jest niższy niż potencjał półogniwa węglowego. W opijanym układzie żelazo jest anodą mikroogniwa, natomiast zarówno grafit, jak i węglik ze.aza pozostająjego katodą. Elektrolitem w opisanym mikroogniwie najczęściej jest woda deszczowa z rozpuszczonymi tlenkami węgla, azotu czy siarki.
Zgodnie z zasadami elektrochemii na powierzchni anody będzie zachodziła reak-; a rozpuszczania żelaza z uwolnieniem jonów Fe2+ do roztworu, natomiast w okolicy v-iody składniki roztworu będą ulegać redukcji. W środowisku kwaśnym powstanie i ektroda z depolaryzacją wodorową, zaś w środowisku obojętnym, w którym stężenie jonów FT jest stosunkowo małe, nastąpi redukcja rozpuszczonego w wodzie i znu, czyli wytworzy się elektroda z depolaryzacją tlenową. Reakcje zachodzące * poszczególnych ogniwach zapisano wzorami (8.20).
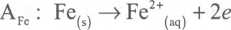
Kc : H20 + ^-02+2e —>2(OH)~ (elektrolit obojętny) (8.20) Kc : 2H+ + 2e“ —> H2 (elektrolit kwasowy)
21 - stający w okolicy katody węglowej nadmiar jonów OH- reaguje z jonami żelaza II i. prowadząc do powstania wodorotlenku żelaza(II), który po utlenieniu tlenem zzzz zsferycznym i uwodnieniu staje się składnikiem rdzy, czyli Fe203 • »H,0. Reak-de podano wyżej (8.18).
Wyszukiwarka
Podobne podstrony:
Slajd16 (21) Mocowanie w podtrzymkach. Jeżeli średnica pręta jest większa niż otwór przelotowy we wr
IMG 09 temperatura, 8 więc i entalpia w końcu sprężania jest większa niż przy sprężaniu izontropowym
Slajd8 CAŁKOWITE WEWNĘTRZNE ODBICIE Jeśli szybkość światła w ośrodku II jest większa niż w ośrodku I
że sztywność podparcia na stopkach antywibracyjnych jest większa niż na platformie i dlatego uznaje
METODA BI 1 □ płomień utleniający, występuje gdy stosunek tlenu do acetylen jest większy niż
Błędy pomiaru: Jeśli obliczona wartość statystyki k, lub K2 jest większa niż wartość krytyczna, nale
niu i obserwacji tego, do czego ono doprowadziło, jest większe niż w innych rodzajach zabaw. Na tema
Document 1 (18) Zagęszczenie bodźców nerwowych biegnących w górę od układu limbicznego jest większe
okresem eksploatacji. Grubość ścianek rur jest większa niż w innych materiałach (dostosowana do
Bezrobocie Bezrobocie Bezrobocie występuje, gdy liczba osób poszukujących pracy jest większa niż lic
74 (114) największa wysokość jest większa niż w przypadku okienka prostokątnego. Zaletą okienek zaok
Szybkość zmian w loT - szanse i zagrożenia „Twoja sieć jest większa niż myślisz. Naprawdę!"Efek
więcej podobnych podstron