skanuj0022 3

HfoCl, * [SnCU2 - 2 Hg° + [SnCI,)2"
biały c/amy
HgyCU + 2 e 2 2Hg° + 2Cr 1
[SnCl4]2“ + 2Cr [SnCI6]2‘ + 2e 1
Po rozpuszczeniu siarczków podgrupy 2A w 6M HNOj, otrzymujemy roztwór azotanów: Pb2*, Bi5', Cu2*, Cd2’ i nadmiar HNO*. Roztwór przelewamy do parowniczki, dodajemy kilka kropli stężanego II2S04 (ostrożnie!!) i odparowujemy, aż do pojawienia się tzw. "białych dymów". Dodanie mało lotnego łł2S04 służy zarówno wytrąceniu PbSOj. jak i usunięciu z roztworu lotnego HNOj.
Dysocjację H2S04 możemy zapisać w dwóch stadiach:
H2SO4 —* Hf + HSOr -jedna strzałka oznacza całkowitą dysocjację HSO4' £ H’ + SO42' -dwie strzałki pokazują istnienie równowagi
dwóch form: kwasowej HS04~ i zasadowej S042" (patrz teoria Brónsteda)
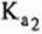
stała dysocjacji kwasowej jonu HS04
Przy wysokich stężeniach jonów H* (»1M), w roztworze pojawia się duże stężenie jonów HS04'. Tym samym ubywa jonów S042". Sytuacja taka jest dla nas niekorzystna, ponieważ wodorosól Pb(HS04)2 jest lepiej rozpuszczalna niż PbSOi. Możemy zapisać to w skrócie:
PbSQ4 + H*
biały mocny kwas
Pb2* + HS04'
produkty dysocjacji Pb(HSO«),
Stężenie jonów H* obniżamy odparowując lotne kwasy (HNO3 w naszym przypadku) - „białe dymy” są sygnałem, że to już się stało i teraz II2S04 zaczyna wrzeć. Po ostudzeniu parowniczki, dodajemy do niej wody destylowanej (2-krotnie rozcieńczamy). Tym razem obniżamy także stężenie H’ zawartych w samym odczynniku strącającym (czyli H2S04). Osad PbSOi odrzucamy - celem wytrącenia nic było wykrycie jonów Pb2‘ lecz usunięcie ich z roztworu analizowanego. Obecność Pb2' wykryliśmy już w toku analizy 1 gr. kationów).
Po wytrąceniu Pb$04, w roztworze możemy spodziewać się obecności siarczanów: Bi3*, Cu2‘, Cd2' i dużego stężenia H2S04. Powoli dodajemy stężony roztwór NH:,aq. Najpierw następuje zobojętnienie H2S04 (reakcja egzotermiczna!!):
NH3aq + H* 2 NH4*
(H;S04)
Następnie, w miarę alkalizacji roztworu (po starannym wymieszaniu roztwór ma zapach NH3), wytrąca się osad BifOHK a jony Cu2' i Cd2’ tworzą rozpuszczalne kompleksy amoniakalne:
Bi5* + 3 NHjaq + 3 H20 S Bi(OH), + 3 NR,*
biały
Cu2, + 4NH5aq £ [Cu(NH3)4]2*
niebieski
Cd2ł + 4NH3aq P [Cd(NHj)4]2’
bezbarwny
Osad Bi(OHOi odwirowujemy, a roztworem zajmiemy się za chwilę -jeżeli jony Cu2’ były w analizie, to intensywnie niebieskie zabarwienie kationów [Cu(NHj)4]2' już jest widoczne.
Aby potwierdzić obecność jonów Bi3’ w osadzie, musimy wytworzyć odpowiedni reduktor. W tym celu należy na wstępie sprawdzić, czy roztwór laboratoryjny SnCl2 odbarwia na zimno, silnie rozcieńczony roztwór KMn04 (SnCl2 jest już zakwaszony HC1 aq). Jeśli odbarwianie Mn04~ jest w yraźne, to SnCI2 nadaje się do użycia (nie został jeszcze utleniony przez 02 z powietrza).
43
Wyszukiwarka
Podobne podstrony:
75647 skanuj0022 (20) Hg,Cl, + [SnCl.,12 -» 2 Hg° + fSnCU]2" biały &nbs
skanuj0023 (18) Do roztworu SnCl2 dodajemy kroplami rozcieńczony NaOH. Pojawia się biały osad SnCOHV
skanuj0009 26. Podać prawidłową wartość ciśnienia krwi Wartość= 120/80 mm Hg Uwaga
skanuj0023 (18) Do roztworu SnCl2 dodajemy kroplami rozcieńczony NaOH. Pojawia się biały osad SnCOHV
skanuj0016 (32) Dla porównania zestawmy teraz reakcje kationów grupy 2A z NH3H20: Dobrze zdysocjowan
skanuj0113 (4) Dwuliścienne Jastrzębiec leśny Jastrzębiec kosmaczek Jastrzębiec baldaszkowy Lepiężni
skanuj0016 Dla porównania zestawmy teraz reakcje kationów grupy 2A z NHyHjO: Dobrze zdysocjowanemu H
skanuj0023 3 Do roztworu SnCl2 dodajemy kroplami rozcieńczony NaOH. Pojawia się biały osad Sn(OHK Za
więcej podobnych podstron