str (45)

|
t |
t |
Ha: (\s' [_tlJ Zr: 5s2 4d2 | Uj h) Sc- Bal
W zasadzie dla pierwiastków bloku d nie stosuje się zapisu elektronów walencyjnych za pomocą wzoru Lewisa.
c) Ni, Cr, Cu, Zr - blok d; Se - blokp, Ba - blok s.
5.70. a) Brom: blok/?, okres 4, grupa 17; b) żelazo: bloki/, okres 4, grupa 8; c) miedź: blok i/, okres 4, grupa 11; d) cynk: blok d, okres 4, grupa 12.
5.71. a) Konfiguracja właściwa dla stanu podstawowego, b) konfiguracja atomu w stanie podstawowym powinna wyglądać następująco: \s2 2s22p6 3s23pb 4s1 3dn), c) konfiguracja atomu w stanie podstawowym powinna wyglądać następująco:
\s2 2s22p6 3s23p6 4s2 3du\
5.72. a) Ne, bo jego atom ma trwałą konfigurację zamkniętopowłokową; b) Ar, bo jego atom ma trwałą konfigurację zamkniętopowłokową; c) Mg, bo jego atom po oddaniu 1 elektronu nie zyskuje korzystnej konfiguracji, natomiast atom Al, oddając
1 elektron, zyskuje konfigurację całkowicie wypełnionego orbitalu s; d) P, bo jego atom po oddaniu 1 elektronu nie zyskuje korzystnej konfiguracji, natomiast atom S, oddając 1 elektron, zyskuje konfigurację połowicznie wypełnionego orbitalu p.
5.73. Cs, Li, B, Be, N.
5.74. a) Ar, bo jego atom ma trwałą konfigurację zamkniętopowłokową; b) Ne, bo jego atom ma trwałą konfigurację zamkniętopowłokową; c) As, bo jego atom po oddaniu
2 elektronów nie zyskuje korzystnej konfiguracji, natomiast atom Ca, oddając 2 elektrony, zyskuje trwałą konfigurację atomu Ar; d) Al, bo jego atom po oddaniu 2 elektronów nie zyskuje korzystnej konfiguracji, natomiast atom Si, oddając 2 elektrony, zyskuje konfigurację całkowicie wypełnionego orbitalu s.
-.75. a) Al3+, Mg2+, Na+ mają wspólną konfigurację ls2 2s22//’; jest to konfiguracja neonu;
b) As3+: ls2 2s22pb 3s23pb 4s2 3dw; Sb3+: ls2 2s22pb 3s23pb 4s2 3dU) 4pb 5s2 4dw; obie te konfiguracje cechują się zamkniętymi podpowłokami s i d\
c) Zn2+: 1 s2 2s22pb 3s23pb 4s2 3dw; Cd2+: ls2 2s22p6 3s23pb 4s2 3d10 4pb 5s2 4dH>; obie te konfiguracje cechują się zamkniętymi podpowłokami s i d.
.70. a) Atom strontu, bo ma więcej powłok; b) atom platyny, bo ma więcej powłok;
c) atom litu, bo jądro o mniejszym ładunku dodatnim słabiej przyciąga elektrony;
d) atom argonu, bo ma więcej elektronów na powłoce walencyjnej i cechuje się budową zamkniętopowłokową.
.77. Atom F, ponieważ jądro o dużym ładunku dodatnim silnie przyciąga elektrony.
.78. Alom Na, ponieważ jądro o małym ładunku dodatnim słabo przyciąga elektrony. .79. a) Atom berylu, b) atom boru.
-80. Podczas wzbudzania elektron w atomie wodoru może zostać przeniesiony na drugą powłokę. Powracając do stanu podstawowego, atom wyemituje światło o niższej energii, czyli światło widzialne.
.81. I a, 2 - d, 3 - a, 4 - b, 5 - a, 6 - c, 7 - b, 8 - d, 9 - c, 10 - b, 11 - b, 12 - d, 13 - d, 14-c, 15-d.
.82.1 b, 2 ab, 3-ctl, 4-d. 5 be, 6 - ab, 7 - c, 8 - a, 9 b, 10 e, 11 b, 12-e, 13
5.83.
a)
I Cl — cl I 0 = 0 IN = NI
H--N-—H
!
H
2+ — 2-Mg IOI
Uwaga. Cząsteczki o wiązaniach jonowych tworzą sieci krystaliczne.
5.84.
a)
IBr-Brl H—Brl K+IBrf
Br2 - 1 wiązanie cr, HBr - 1 wiązanie <J; KBr tworzy sieć krystaliczną.
b)
b)
H—CII
H H
y&
</ V
\b/

Na+ ISI 2“ Na+ Ba2+ ISI 2"
H H
H2S - 2 wiązania a; Na2S i BaS tworzą sieci krystaliczne.
c)
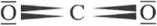
C02 - 2 wiązania o i 2 wiązania 71; CH4 - 4 wiązania o; CS2 - 2 wiązania <7 i 2 wiąza nia 71.
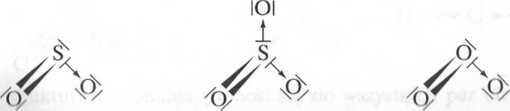
Wr ws/yslMch cząsteczkach występują wiązania koordynacyjne i kowalencyjne spolaryzowane
Wyszukiwarka
Podobne podstrony:
89064 str (45) Ha: [ U 1 t t Zr: 5s2 4d2 Qj] h) -Sc- Bal W zasadzie dla pier
6. 7. siłowej d) 40-50% rezerwy tętna, 30-45 min, nie stosuje się treningu wytrzymałości b)
str. 45 OPIS TECHNICZNY Do projektu wykonawczego automatyki i pomiaru wymiennikowego węzła ciepłowni
Skrypt str 3 239 Ha rysunku tym widoczne Jest narastanie warstwy przyściennej w kierunku przepływu.
str. 45 V. Formy i metody działania administracji stosowane w negocjacjach i mediacjach str. 46 Lite
str. 45 OPIS TECHNICZNY Do projektu wykonawczego automatyki i pomiaru wymiennikowego węzła ciepłowni
Zelbet Exam 2 Termin 1 str 0004 2 7 %Qsvsaąą — ®T^Gtr f^Je^yicf/uj, yd^o^d/u. 1/ ^
Chemia pH str 8 45 [H4J = 0,0045 ’kw Ciw = 0,1 mol/dm3 PRZYKŁAD 10 Ile gramów NaOH należ} użyć do s
ZADANIA STR 45 */ A. tr }«■ cti tH> > 3 Ł Id Obitej xu jx>moca mełodi/ (i
2.3. Klasyfikacja audytu I str. 45 2.4. Literatura I str. 48 2.5
£/> *= 0 O - 2>[2ql ■ cos a = 0 => H A — 2^2ql • cos 45° =>HA = 2yf2ql
więcej podobnych podstron