CCF20100422�008 (2)
ROZDZIAŁ 9 Strategie katalityczne
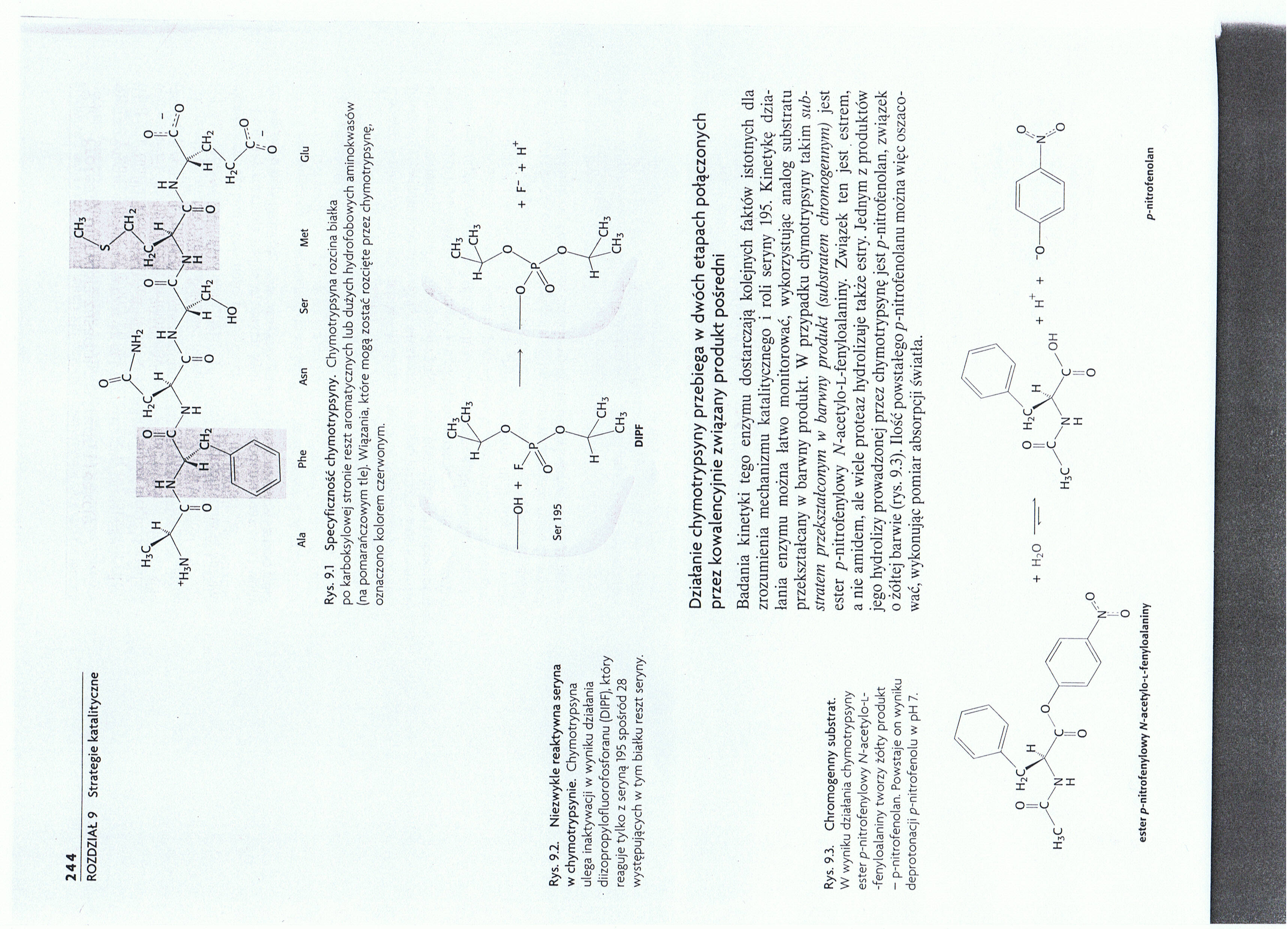
Ala Phe Asn Ser Met Glu
Rys. 9.1 Specyficzność chymotrypsyny. Chymotrypsyna rozcina białka po karboksylowej stronie reszt aromatycznych lub dużych hydrofobowych aminokwasów (na pomarańczowym tle). Wiązania, które mogą zostać rozcięte przez chymotrypsynę, oznaczono kolorem czerwonym.
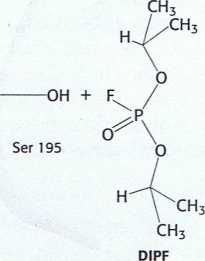
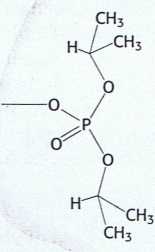
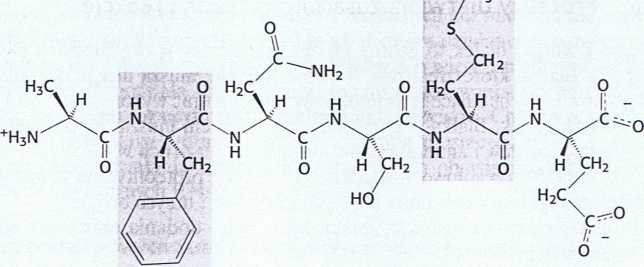
+ F" + H+
Rys. 9.2. Niezwykle reaktywna seryna w chymotrypsynie. Chymotrypsyna ulega inaktywacji w wyniku działania ■ diizopropylofluorofosforanu (DIPF), który reaguje tylko z seryną 195 spośród 28 występujących w tym białku reszt seryny.
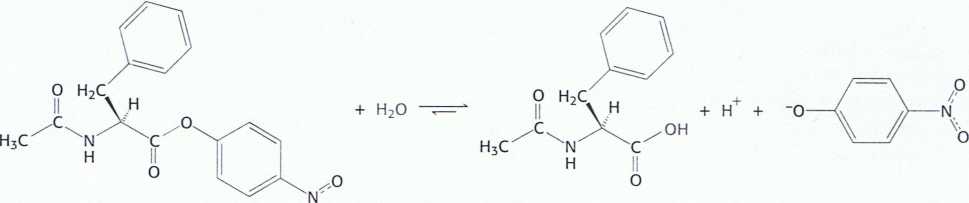
Rys. 9.3. Chromogenny substrat.
W wyniku działania chymotrypsyny ester p-nitrofenylowy N-acetylo-L--fenyloalaniny tworzy żółty produkt - p-nitrofenolan. Powstaje on wyniku deprotonacji p-nitrofenolu w pH 7.
Działanie chymotrypsyny przebiega w dwóch etapach połączonych przez kowalencyjnie związany produkt pośredni
Badania kinetyki tego enzymu dostarczają kolejnych faktów istotnych dla zrozumienia mechanizmu katalitycznego i roli seryny 195. Kinetykę działania enzymu można łatwo monitorować, wykorzystując analog substratu przekształcany w barwny produkt. W przypadku chymotrypsyny takim sub-stratem przekształconym w barwny produkt (substratem chromogennym) jest ester p-nitrofenylowy N-acetylo-L-fenyloalaniny. Związek ten jest estrem, a nie amidem, ale wiele proteaz hydrolizuje także estry. Jednym z produktów jego hydrolizy prowadzonej przez chymotrypsynę jest p-nitrofenolan, związek o żółtej barwie (rys. 9.3). Ilość powstałegop-nitrofenolanu można więc oszacować, wykonując pomiar absorpcji światła.
o
ester p-nitrofenylowy W-acetylo-L-fenyloalaniny p-nitrofenolan
Wyszukiwarka
Podobne podstrony:
CCF20100422�012 248 ROZDZIAŁ 9 Strategie katalityczne Ser 195 Met 192 Rys. 9.10 Kieszeń gwarantująca
CCF20100422�010 (2) 246 ROZDZIAŁ 9 Strategie katalityczne —t . Rys. 9.6 Lokalizacja miejsca ^ aktywn
więcej podobnych podstron