CCF20100422�012

248
ROZDZIAŁ 9 Strategie katalityczne
Ser 195
Met 192
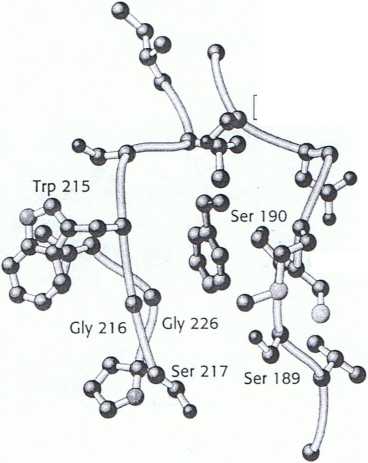
Rys. 9.10 Kieszeń gwarantująca specyficzność chymotrypsyny.
Zauważ, że kieszeń ta jest wysłana hydrofobowymi resztami i stosunkowo głęboka, co umożliwia wiązanie reszt
z długi ;., I hydrofobowymi łańcuchami bocznymi takich aminokwasów jak fenyloalanina (oznaczona kolorem zielonym). Zauważ także, że reszta seryny znajdująca się w miejscu aktywnym (seryna 195) zajmuje pozycję umożliwiającą przecięcie wiązania peptydowego między resztą wiązaną w kieszeni i kolejną resztą aminokwasową w sekwencji. Zaznaczono kluczowe aminokwasy tworzące miejsce wiązania.
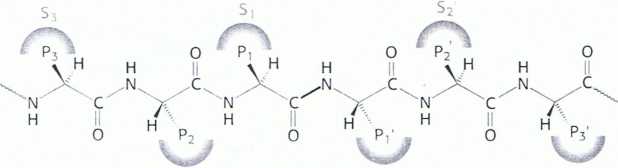
nie pcptydowe w odpowiedniej orientacji do miejsca aktywnego, co umożliwia hydrolizę (rys. 9.10). Specyficzność chymotrypsyny zależy prawie całkowicie od tego, jaki aminokwas znajduje się w części aminowej rozcinanego wiązania peptydowego. Inne proteazy wykazują bardziej skomplikowany wzór specyficzności, co pokazano na rys. 9.11. Enzymy te mają dodatkowe kieszenie na swej powierzchni, umożliwiające rozpoznanie innych reszt w substracie. Reszty po stronie aminowej rozszczepianego wiązania oznaczono Pj, P2, P3 i tak dalej, wskazując ich pozycję w stosunku do tego wiązania. Analogicznie, reszty po stronie karboksylowej rozszczepianego wiązania oznaczono Pj', P2', P3' i tak dalej. Odpowiadające im miejsca na enzymie oznaczono Sj, S2 lub S]', S2' i tak dalej.
S2 s,’ s,'
Rys. 9.11 Nazewnictwo określające specyficzność oddziaływań enzym-
-substrat. Potencjalne miejsca oddziaływania substratu z enzymem oznaczono litera P (kolor czerwony) a odpowiednie miejsca wiążące na enzymie oznaczono litera S. Punktem odniesienia jest rozszczepiane wiązanie (także kolor czerwony).
Triady katalityczne występują w innych enzymach hydrolitycznych
T Triady katalityczni podobne do występującej w chymotrypsynie odkryto następnie w wielu innych białkach. Niektóre z nich, takie jak trypsyna i elastaza, to ocz\nviste homologi chymotrypsyny. Ich sekwencja aminokwasowa jest w 40% identyczna z sekwencją chymotrypsyny, a struktura przestrzenna jest prawie taka sakna (rys. 9.12). Białka te w swym działaniu wykorzystują mechanizm identyczny z opisanym dla chymotrypsyny. Jednak bardzo wyraźnie różnią się od chymotrypsyny specyficznością substratową. Chymotrypsyna rozcina wiązanie peptydowe za resztami aminokwasowymi zawierającymi aromatyczne lub długie nicpolarne łańcuchy boczne. Trypsyna rozcina wiązanie peptydowe za resztami, Których łańcuchy boczne są długie i obdarzone ładunkiem dodatnim, czyli resztami argininy i lizyny. Elastaza rozcina wiązanie peptydowe za resztami z małymi łańcuchami bocznymi, takimi jak reszty alaniny i seryny. Porównanie, kieszeni Sj tych enzymów wskazuje, iż obserwowane różnice specyficzności sk spowodowane niewielkimi różnicami w strukturze. W trypsynie na dnie kieszeni Sj, w miejscu reszty se-
Wyszukiwarka
Podobne podstrony:
CCF20100422�010 (2) 246 ROZDZIAŁ 9 Strategie katalityczne —t . Rys. 9.6 Lokalizacja miejsca ^ aktywn
CCF20100422�008 (2) ROZDZIAŁ 9 Strategie katalityczne Ala
CCF20121219�003 Si < 5 cmNiektóre warunki: S°1 “ 0,2 h s01 < 5 cm sGi < 0
CCF20140217�046 190 Rozdział 6. Planowanie zasobów ludzkich Plan strategiczny jak drogowskaz wytycza
więcej podobnych podstron