CCF20100422�010 (2)

246
ROZDZIAŁ 9 Strategie katalityczne
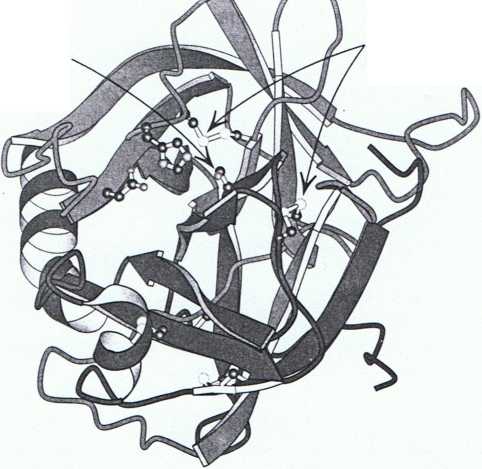
—t . Rys. 9.6 Lokalizacja miejsca ^ aktywnego w chymotrypsynie.
Chymotrypsyna składa się z trzech łańcuchów, pokazanych w modelu wstęgowym kolorem odpowiednio pomarańczowym, niebieskim i zielonym. Łańcuchy boczne reszt triady katalitycznej pokazano wykorzystując model kulkowy. Zauważ, że te łańcuchy boczne, łącznie z seryną 195, znajdują się w miejscu aktywnym zlokalizowanym w górnej połowie przedstawionej struktury. Zauważ także, że dwa wewnątrzłańcuchowe i dwa międzyłańcuchowe wiązania dwusiarczkowe znajdują się w różnych miejscach przedstawionej cząsteczki.
[Za: IGCT.pdb.]
seryna 195
mostki
dwusiarczkowe
W obecności substratu reszta histydyny jest akceptorem protonu pochodzącego z grupy hydroksylowej seryny 195. Reszta działa jako uniwersalny katalizator zasadowy. Usunięcie protonu z grupy hydroksylowej prowadzi do powstania jonu alkoholanowego, który jest znacznie silniejszym nukle-ofilem niż alkohol. Reszta asparaginianu zapewnia odpowiednią orientację reszty histydyny i poprawia jej działanie jako akceptora protonu dzięki efektom elektrostatycznym.
Obserwacje te wskazują na mechanizm hydrolizy peptydu (rys. 9.8). Po związaniu substratu (etap 1) reakcja rozpoczyna się atakiem nukleofilo-wym atomu tlenu łańcucha bocznego seryny 195 na atom węgla grupy karbo-nylowej docelowego wiązania peptydowego (etap 2). Atak nukleofilowy zmienia liczbę atomów związanych z atomem węgla grupy karbonylowej z trzech na cztery i ich geometrię z płaskiej trójkątnej na tetraedryczną. Powstały, z definicji niestabilny, tetraedryczny produkt pośredni ma ładunek ujemny, zlokalizowany na atomie tlenu pochodzącym z grupy karbonylowej. Ładunek ten jest stabilizowany przez oddziaływania z grupami NH białka, zachodzące w miejscu nazywanym dziurą oksyanionową (ang. oxyanion hole) (rys. 9.9). Oddziaływania te umożliwiają także stabilizację stanu przejściowego, który poprzedza powstanie tetraedrycznego produktu pośredniego. Następnie tetraedryczny produkt pośredni rozpada się, co prowadzi do utworzenia acyloenzymu (etap 3). Etap ten jest ułatwiony dzięki przeniesieniu protonu z dodatnio naładowanej reszty histydyny na grupę aminową powstałą w wyniku rozerwania wiązania peptydowego. Składnik aminowy jest uwalniany

Rys. 9.7 Triada katalityczna. Triada katalityczna, pokazana po lewej stronie, przekształca serynę 195 w silny nukleofil, przedstawiony po prawej stronie.
Wyszukiwarka
Podobne podstrony:
CCF20100422�012 248 ROZDZIAŁ 9 Strategie katalityczne Ser 195 Met 192 Rys. 9.10 Kieszeń gwarantująca
CCF20100422�008 (2) ROZDZIAŁ 9 Strategie katalityczne Ala
CCF20130218�006 16 Rozdział 0.1. Soczewki Jeżeli przedmiot znajduje się pomiędzy ogniskiem i soczewk
CCF20140217�046 190 Rozdział 6. Planowanie zasobów ludzkich Plan strategiczny jak drogowskaz wytycza
CCF20140217�048 192 Rozdział 6. Planowanie zasobów ludzkich zakłada szybką ekspansję rynkową, strate
więcej podobnych podstron