LastScan2 (5)

ZMIANY ENERGII W REAKCJACH ENZYMATYCZNYCH
* Enzymy to katalizatory organiczne, czyli biokatalizatory.
Przyspieszają reakcje termodynamicznie korzystne (egzoergiczne) oraz reakcje termodynamicznie niekorzystne (endoergiczne) sprzężone z reakcjami egzoergicznymi,
• Enzymy działając jako biokatalizatory :
zwiększają prawdopodobieństwo zderzeń reagujących cząsteczek; ukierunkowują względem siebie reagujące cząsteczki; obniżają energię aktywacji reagujących cząsteczek.
Energia aktywacji to najmniejsza porq'a energii, którą trzeba dostarczyć
1 molowi substratów, aby każda z cząsteczek stała się reaktywna.

SoytK, Cocepłs m Biochemistry, 2001
AG* = GS*-GS
AG*-energia aktywacji - to różnica energii swobodnej stano przejściowego i substraiu w stanie podstawowym.
Teoria stanu przejściowego
t) w centrum aktywnym enzymu cząsteczki (S) o energii co najmniej równej energii aktywacji zderzają stę ze sobą;
2) w momencie efektywnego zderzenia następuje przegrupowanie elektronów walencyjnych tych cząsteczek i tworzy się nietrwały układ zwany stanem przejściowym (kompleks enzym - substrat, ES), w stanie przejściowym przy określonej Konfiguracji atomów, energia osiąga wartość maksymalną;
3) kompleks enzym-substrat rozpada się i następuje uwolnienie produktu (P) oraz cząsteczki enzymu.
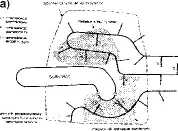
CENTRUM (MIEJSCE) AKTYWNE ENZYMU
CENTRUM (MIEJSCE) AKTYWNE ENZYMU - to miejsce w cząsteczce enzymu, do którego przyłączają się substraty (a).
Łańcuchy boczne aminokwasów budujących centrum aktywne mogą leżeć w różnych miejscach liniowej sekwencji aminokwasów;
W połączeniach E-S biorą udział słabe wiązania {o sile 12-50 kJ/mol); Centra aktywne są zagłębieniami tub szczelinami niedostępnymi dla wody; Specyficzność wiązania substratu zależy od precyzyjnie określonego ułożenia atomów w centrum aktywnym (b).
BADANIE AKTYWNOŚCI ENZYMÓW
Miarą aktywności enzymu jest ilość substratu przekształconego w jednostce czasu lub ilość produktu powstałego w jednostce czasu przeliczona na ilość badanego materiału. Aktywność enzymu wyraża się w jednostkach aktywności.
Jednostka uniwersalna ( standardowa) to taka ilość enzymu, która katalizuje przemianę 1 pmola substratu w ciągu 1 min., w temperaturze 30°C i optymalnych warunkach pH oraz stężenia substratu.
Katal to taka ilość enzymu, która w ciągu 1 sekundy , w temperaturze 30°C i optymalnych warunkach pH oraz stężenia substratu powoduje przemianę 1mola substratu.
Aktywność molekularna jest to ilość mmoli substratu przekształcona w ciągu 1 min. w standardowych warunkach przez 1 pmol enzymu.
Aktywność właściwa określa liczbę jednostek uniwersalnych enzymu w przeliczeniu na 1 mg białka
Wyszukiwarka
Podobne podstrony:
02LastScan2 ZMIANY ENERGII W REAKCJACH ENZYMATYCZNYCHENZYMY JAKO KATALIZATORY Enzymy to katalizatory
img371 (4) V D. Krzywa nb" oznacza zmiany energii reagujących cząstek v obecności katalizatora
DSC00018 (21) Przyspieszanie reakcji przez enzymy energia swobodna > energia swobodna B Zmiany en
DSC03278 (4) Kataliza i procesy katalityczne Zmiany energii substratów Rezeczy wiste zmiany energii
enzymy12 106 Sekcja C - Em lodynamfka Rys. 1. Zmiany energii zachodzące podczas przebiegu reakc
114 Enzymy4.2. SZYBKOŚĆ REAKCJI ENZYMATYCZNEJ Miarą aktywności enzymu jest szybkość katalizowanej
WYKŁAD 2 enzymy cz 1 (25) AKTYWNOŚĆ ENZYMÓW MÓZE BYĆ REGULOWANACzynniki wpływające na szybkość re
więcej podobnych podstron