CCI20090324�013

13
Oznaczanie przewodności elektrolitycznej właściwej metodą
konduktometryczną
1. Zasada metody
Przewodność elektrolityczna roztworu określa jego zdolność do przewodzenia prądu elektrycznego. Przenośnikiem prądu w roztworze są jony. Wielkość przewodności jest proporcjonalna do stężenia substancji mineralnych występujących w postaci jonowej (elektrolitów). Zdolność roztworu wodnego do przewodzenia prądu elektrycznego pod wpływem przyłożonego napięcia na elektrody nazywa się przewodnością elektryczną.
Przewodność właściwa % jest przewodnością słupa roztworu o przekroju 1 cm2 i wysokości 1 cm. Wynik pomiaru zależy od temperatury, należy zaznaczyć, jakiej temperatury dotyczy (np. EC2q - przewodność w temp. 20°C). Jako standardową uznaje się najczęściej temperaturę 25°.
Jednostką przewodności jest simens (odwrotność oma) - symbol S.
Przewodność elektrolityczną właściwą wody podaje się zwykle w mS/cm, a przy niskiej mineralizacji w pS/cm.
Świeża woda destylowana ma %=0,5-5-2,0 pS/cm, przechowywana kilkanaście dni 2-5-4 pS/cm, wskutek pochłaniania dwutlenku węgla i amoniaku z powietrza. Przewodność właściwa wód naturalnych waha się przeciętnie w granicach od 50 do 1000 pS/cm. Duży wpływ na wartość przewodności wód powierzchniowych mają ścieki, przede wszystkim przemysłowe, których przewodność sięga 10 000 pS/cm.
2. Sprzęt:
Konduktometr, czujnik konduktometryczny (zestaw dwóch elektrod platynowych pokrytych czernią platynową), czujnik temperatury, zlewki poj. 25 ml, termometr.
3. Wykonanie oznaczenia
Badaną próbkę wody wlać do zlewki, doprowadzić temperaturę wody do 25°C, następnie według instrukcji obsługi konduktometru zmierzyć przewodność elektrolityczną. Przewodność właściwą wody % oblicza się następująco:
z-k - z 1 pS/cm
gdzie: zi- zmierzona przewodność na konduktometrze
k - stała konduktometryczną
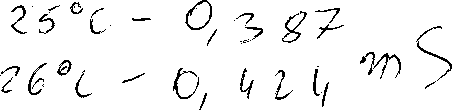
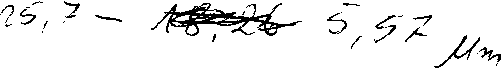
Wyszukiwarka
Podobne podstrony:
img612 13Oznaczanie przewodności elektrolitycznej właściwej metodąkonduktometryczną1. Zasada
Charakterystycznym parametrem materii jest przewodność elektryczna właściwa (konduktywność) oznaczan
CCI20090324�011 11 Oznaczanie zawartości sodu i potasu metodą fotometrii płomieniowej Zasada metody
Zdjęcia 0128 5.3. Zastosowanie Woda jes, bardzo złym przewodnikiem elektryt— właściwa bardzo czystej
Tabi.ica 5.1. Oznaczenia przewodów elektroenergetycznych do układania na stałe Symbol literowy i j
Przewodność elektryczna właściwa Km -
54812 Image4 (56) OZNACZENIA PRZEWODÓW ELEKTROENERGETYCZNYCH Grupa oznaczeń —
Czynniki kształtujące odczyn i przewodność elektrolityczną właściwą ekstraktów wodnych kory sosny
img065 Pomiar przewodnictwa elektrycznego mleka aparatem Dramińskiego Zasada oznaczenia polega na wy
str34 (16) Konduktometria Konduktometria jest metodą opartą o pomiar przewodnictwa elektrycznego
więcej podobnych podstron