Image52 (16)

191 Rozwiązania zadań ze zbioru "MENDLA
Zadanie 692 str.138
Szukane:
P2, Vi, V3
Dane:
n = 1 mol
pi = 1 MPa = 1000000 Pa Ti = 390 K
AU = -7,17 kJ = -7M0 J W = - 745 J
cv = 21,63 R = 8,31
mol■ K J
K ■ mol
Z równania gazu doskonałego Clapeyrona otrzymamy:
= n • R /• Ti Ti
n • R • Ti
pi • Vi = n ■ R • Ti —^ Vi =
Pi
Najpierw gaz poddano przemianie izochorycznej, V = const, oraz V2 = Vi.
Z I zasady termodynamiki wiadomo, że
AU = Q + W , ale W = 0 stąd Q = AU , lecz Q = cv • n • AT
AU = cv • n • (T2-T1) /: cv • n
AU
więc praca Wi = 0
AT = T2 - Ti
T2-Ti = T2 = Ti +
cv • n AU
cv • n
Zgodnie z prawem przemiany izochorycznej:
Pl = P2
Ti T2
P2 =
P1 • T2
P1
stąd p2 =
^ AU
Ti +-
cv • n
P2 = pi
; Ti
1 +
AU
cv • n • Ti
Obliczymy teraz liczbowe ciśnienie p2 i objętość Vi.
-7170 J
P2 = 1 MPa
1 +
21,63
K ■ mol
1 mol ■ 390 K
p2 = 1 MPa ■ (1 - 0,85) p2 = 0,15 MPa = 150 kPa
vi=n^i
Pi
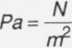
1 mol • 8,31 ~--y 390 K y,___K • mol_
1 “ 1000000 Pa ’ J =
V1 = 0,00324-^^
N
rr?
Vi = 0,00324m3 = 3,24 dm3
Ze stanu 2 do 3 gaz przeszedł rozprężając się izobarycznie p = const, więc wykonaną pracę W wyrazimy:
W = - p • AV , ale aV = V3 - M2
stąd W = - p2 • (V3 - V2)
Przekształcając ostatnie równanie wyznaczymy końcową objętość gazu Mz.
W = - p2 • V3 + p • V2
P2 • V3 = P2 • V2 - W /: P2
w w W , w w n • R • Ti
V3 = V2-— , lecz V2 = Vi=-
P2 P1
oraz p2 = pi
1 +
AU
cv • n • Ti
Po podstawieniu:
n • R • Ti
V3 =
W
Pi
P1
V3 = 3,24 dm3 -
1 +
AU
-745 J 150 kPa
cv • n • T1
J= N- m
Pa-
_N_
m2
V3 = 3,24 drr? + 0,00497-^p
m2
V3 = 3,24 dm3 + 4,97dm3 V3 = 8,21 dm3
Odp.: Objętość początkowa gazu wynosi 8,21 dm3. Ciśnienie gazu po przemianie izochorycznej wynosiło 150 KPa.
13 — Zeszyt 5
Wyszukiwarka
Podobne podstrony:
Image54 (16) 195 Rozwiązania zadań ze zbioru "MENDLA Ostatecznie pobrane ciepło jest równe: 195
Image50 (16) 187 Rozwiązania zadań ze zbioru "MENDLA" Objętość końcową V2 obliczymy korzys
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image53 (14) 193 Rozwiązania zadań ze zbioru "MENDLA Dane: n = 1 mol Q = 6,16 kj= 6160 J t
Image49 (16) 185 Rozwiązania zadań ze zbioru "MENDLA" Q - K P • AV K - 1 1,4 • 200000 Pa •
więcej podobnych podstron