Image49 (16)
185 Rozwiązania zadań ze zbioru "MENDLA"
Q - K P • AV K - 1
1,4 • 200000 Pa • 0,5 m3
Q =
1,4-1
Pa =
A/
Q = 350000-^ • m3 rrr
Q = 35t) kJ
Zgodnie z I zasadą termodynamiki zmiana energii wewnętrznej wyrażamy wzorem:
AU = W + Q
AU = - 100 kJ+ 350 kJ = 250 kJ
Odp.: W czasie przemiany gaz pobrał 350 kJ ciepła, wykonując 100 kJ pracy i zwiększając ową energię wewnętrzną o 250 kJ.
Zadanie 688 str.137
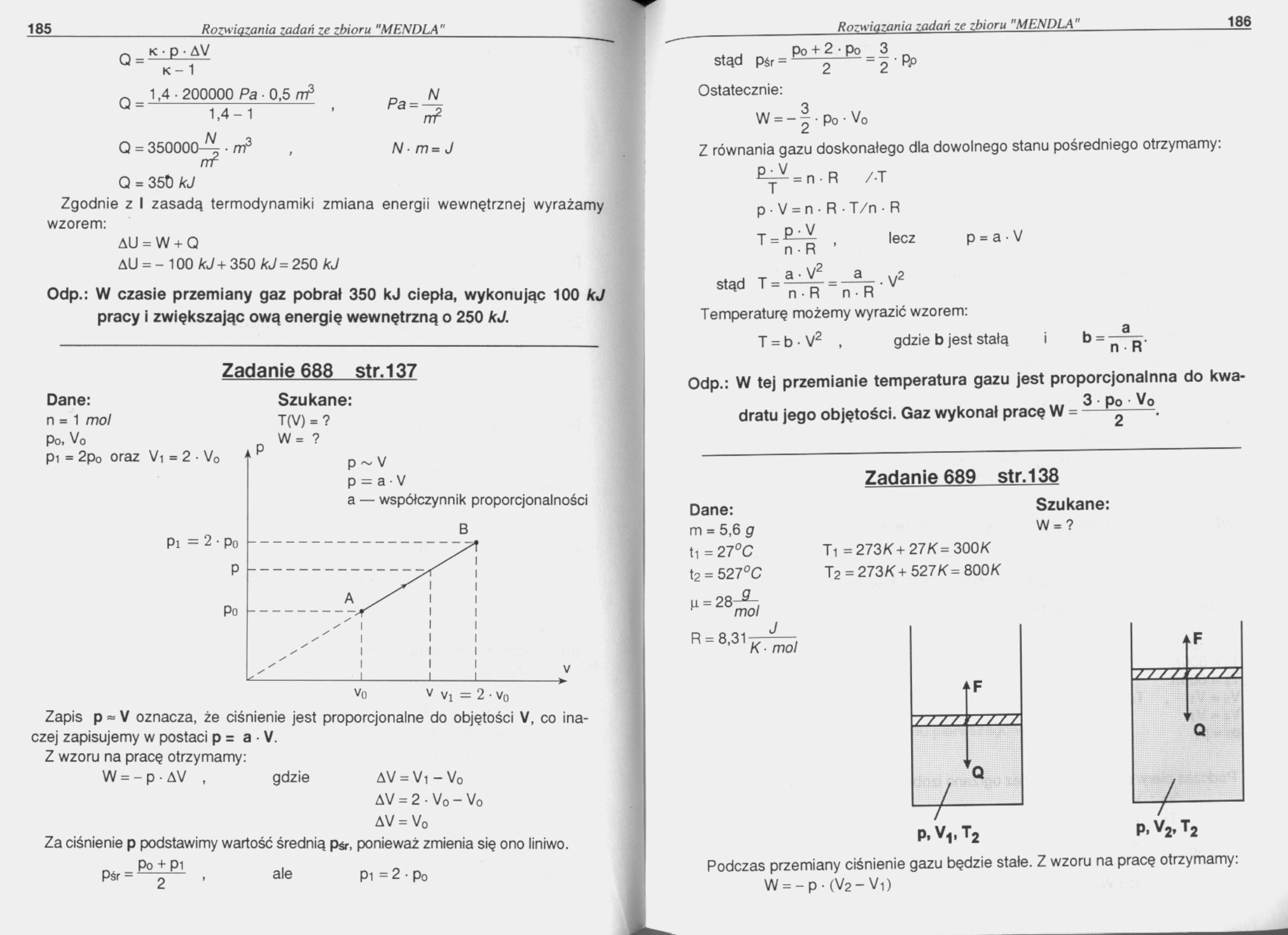
Dane: Szukane:
n = 1 mol T (V) = ?
Zapis p = V oznacza, że ciśnienie jest proporcjonalne do objętości V, co inaczej zapisujemy w postaci p = a • V.
Z wzoru na pracę otrzymamy:
W = - p • AV , gdzie AV = Vi-V0
AV = 2 • V0 - V0 AV = V0
Za ciśnienie p podstawimy wartość średnią p^r, ponieważ zmienia się ono liniwo.
ale
P1 = 2 • po
po + 2 • po 3
Stąd Pśr= 2 — = 2'PP Ostatecznie:
W = -|po-Vo
Z równania gazu doskonałego dla dowolnego stanu pośredniego otrzymamy: RiV_
= n•R /T
i
pV = n- R*T/nR
T =
stąd T =
n • R a -V2
lecz • V2
p = a • V
n • R n • R Temperaturę możemy wyrazić wzorem:
T = b • V2 , gdzie b jest stałą
b =
n R
Odp.: W tej przemianie temperatura gazu jest proporcjonalnna do kwa
dratu jego objętości. Gaz wykonał pracę W =
3 po Vq
|
Dane: |
Szukane: | ||
|
m = 5,6 g |
w = ? | ||
|
ti =27 °C |
Ti = 273K" +27K= 300K | ||
|
t2 = 527°C |
T2 = 273K+ 527K= 800K | ||
|
li = 28-2-. r moi R = 8,31-77-^—. K ■ mol | |||
|
7777- |
7777 |
|
/ |
Q |
Podczas przemiany ciśnienie gazu będzie stałe. Z wzoru na pracę otrzymamy:
W = - p • (V2 - Vi)
Wyszukiwarka
Podobne podstrony:
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
18469 Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru &q
18469 Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru &q
69485 Image43 (19) 173 Rozwiązania zadań ze zbioru "MENDLA " k = n • R • T n- R T-W Odp.:
Image42 (19) 171 Rozwiązania zadań ze zbioru "MENDLA” Za pi • Vi do pracy W podstawimy n R • Ti
Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru "ME
Image48 (15) 183____Rozwiązania zadań ze zbioru "MENDLA"_ W przemianie B-C praca W2 = O, w
Image4 (61) 88 Rozwiązania zadań ze zbioru "MENDLA" V1 • T2 = Ti • (Vi + Ah • S) Vi -T2 =
Image4 (62) 62 Rozwiązania zadań ze zbioru "MENDLA"_ Z równania gazu doskonałego dla stanó
Image4 (63) 12 Rozwiązania zadań ze zbioru "MENDLA" 0,0001 0,003 = 3-10~
Image54 (16) 195 Rozwiązania zadań ze zbioru "MENDLA Ostatecznie pobrane ciepło jest równe: 195
Image4 (63) 12 Rozwiązania zadań ze zbioru "MENDLA" 0,0001 0,003 = 3-10~
więcej podobnych podstron