Image4 (61)

88 Rozwiązania zadań ze zbioru "MENDLA"
V1 • T2 = Ti • (Vi + Ah • S)
Vi -T2 = Ti • Vi + TiAh • S) Ti • Ah • S = Vi • T2 - T1 • Vi
Vi (T2-Ti)
/: Ti • S
Ah =
Ah =
TiS
2-10" 3/773 • (330K - 300K) 300/< • 0,01 m2
Ah =
0,002m- 30K 3K
= 0,02/77 = 2cm
Odp.: Po ogrzaniu gazu tłok podniesie się o 2 cm.
Zadanie 598 str.120
Szukane:
Ti-?
Dane:
AT=1 K
n = 305
Z warunków zadania wynika, że po ogrzaniu następuje przyrost objętości AV równy:
AV = n • Vi
Końcowa objętość V2 gazu po ogrzaniu będzie:
V2 = Vi + AV V2 = Vi + n ■ Vi V2 = Vi(1 + n)
Zgodnie z prawem Gay-Lussaca mamy: yi V2 Ti T2
Vi-T2 = V2-Ti, gdzie T2 = Ti-i-AT
Po podstawieniu V2 i T2 otrzymamy:
Vi .(Ti +AT) = Vi -(1 +n) Ti /:Vi Przekształcając ostatnie równanie obliczymy Ti.
Ti+AT = Ti + n- Ti /: n
305
Ti = 305/<
Odp.: Temperatura początkowa gazu wynosiła 305 K.
Dane:
Zadanie 599 str.120
Szukane:
Tb = ?
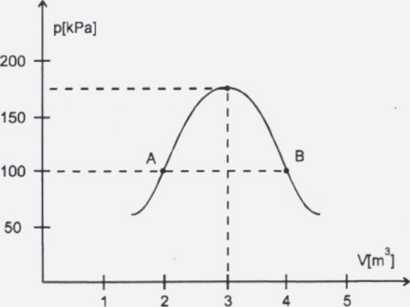
Ta = 200K
Z wykresu odczytaliśmy: Va = 2 m3
Vb = 4m3 ; pa = pb
Gaz ze stanu A do stanu B można również przeprowadzić w wyniku przemiany izobarycznej. Z wykresu mamy pa = Pb, więc zgodnie z prawem Gay-Lussaca zapiszemy:
Va _ Vb Ta Tb
Va • Tb = Vb • Ta Vb • Ta
/:VA
Tb =
Tb =
Va
4m3 • 200K
2 nr Tb = 400K
Odp.: Temperatura gazu w stanie opisanym punktem B wynosi 400K.
Zadanie 600 str.120
Po ogrzaniu gazu między objętością końcową i początkową mamy zależność: V2 .. n = v7 / v' stąd V2 = n • Vi
Wyszukiwarka
Podobne podstrony:
18469 Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru &q
18469 Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru &q
69485 Image43 (19) 173 Rozwiązania zadań ze zbioru "MENDLA " k = n • R • T n- R T-W Odp.:
Image42 (19) 171 Rozwiązania zadań ze zbioru "MENDLA” Za pi • Vi do pracy W podstawimy n R • Ti
Image45 (15) 177 Rozwiązania zadań ze zbioru "MENDLA 177 Rozwiązania zadań ze zbioru "ME
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image48 (15) 183____Rozwiązania zadań ze zbioru "MENDLA"_ W przemianie B-C praca W2 = O, w
Image49 (16) 185 Rozwiązania zadań ze zbioru "MENDLA" Q - K P • AV K - 1 1,4 • 200000 Pa •
Image4 (62) 62 Rozwiązania zadań ze zbioru "MENDLA"_ Z równania gazu doskonałego dla stanó
Image4 (63) 12 Rozwiązania zadań ze zbioru "MENDLA" 0,0001 0,003 = 3-10~
Image46 (16) 179 Rozwiązania zadań ze zbioru "MENDLA —Zadanie 684 str.136Dane: Q = 100 kJ W = 6
Image4 (63) 12 Rozwiązania zadań ze zbioru "MENDLA" 0,0001 0,003 = 3-10~
więcej podobnych podstron