skan0228

Kinetyka chemiczna 231
W przybliżeniu stanu stacjonarnego mamy
= ki[A]" - *2[L][A] + ak2[L][A] - *3[L] = 0,
skąd
[L]
(5.42)
Gdy a > 1 (reakcja łańcuchowa rozgałęziona), może dojść do sytuacji, w której mianownik tego wyrażenia będzie równy zeru, co oznacza nieograniczony wzrost stężenia nośników łańcucha i - w konsekwencji - grozi wybuchem.
Jeżeli reakcja rzędu ;? przebiega nie w układzie statycznym, lecz dynamicznym (np. w reaktorze przepływowym), to stałą szybkości reakcji, po osiągnięciu przez układ stanu stacjonarnego, wyraża równanie
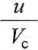
c/
J
dc.
CA
(5.43)
gdzie u jest szybkością przepływu mieszaniny reakcyjnej przez reaktor (np. w m3 • s-1), Vc jest objętością całkowitą reaktora, cAA oraz cA2 są stężeniami sub-stratu A, odpowiednio, na wlocie i wylocie reaktora.
Zależność stałej szybkości od temperatury przedstawia równanie Arrheniusa
(5.44)
d\nk _ Ea dT _ RT2 '
Jego scałkowanie, przy założeniu niezależności EA od temperatury, prowadzi do wyrażenia
A: = ^ exp (5.45)
w którym A oznacza czynnik przedeksponencjalny, zwany też czynnikiem częstości, EA zaś jest energią aktywacji według Arrheniusa.
Przykład 5.14. Doświadczalne wartości stałej szybkości autokatalityczne-go utleniania hydroksylaminy w obecności EDTA
J[NH7OH] ,
- d] ' = WNH20H][02]
w kilku temperaturach wynoszą
|
T[ K] |
273 |
283 |
288 |
298 |
307,5 |
|
*ek,p 104 [M-'S-'] |
0,273 |
0,680 |
1,02 |
2,64 |
5,90 |
Wyszukiwarka
Podobne podstrony:
43910 PC020598 PRZYBLIŻENIE STANU STACJONARNEGO Rozważmy reakcję: fc-l Ir A^B4D której kinetykę opis
PC020598 PRZYBLIŻENIE STANU STACJONARNEGO Rozważmy reakcję: fc-l Ir A^B4D której kinetykę opisuje uk
43910 PC020598 PRZYBLIŻENIE STANU STACJONARNEGO Rozważmy reakcję: fc-l Ir A^B4D której kinetykę opis
PC020609 [Uwzględnienie warunku k2 « k.t oraz zastosowanie I przybliżenia stanu stacjonarnego, prowa
skan0218 Kinetyka chemiczna 221 w którym po etapie (1), z szybko ustalającą się równowagą, następuje
skan0200 (2) Kinetyka chemiczna 203 Szybkość reakcji A B zgodnie z równaniem (5.1) wyraża się
skan0242 Kinetyka chemiczna 245 Rozwiązanie. Stopień pokrycia węgla aktywnego etenem, <9, definiu
więcej podobnych podstron