Image14 (37)

32 Rozwiązania zadań ze zbioru "MENDLA
Napiszemy równanie Clapeyrona dla naczynia pierwszego:
p-i • V = — • R • T /: V Pi
rm • R • T
stąd pi =
pi • V
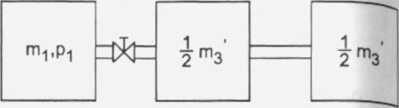
Nieznane wielkości m, p, T, V znajdujemy z innych zależności.
Po zamknięciu zaworu drugiego i otwarciu zaworu pierwszego ciśnienia w obu naczyniach wyrównają się osiągając jednakową wartość p.
Objętość obu naczyń wynosi Vc = 2 • V, a całkowita masa gazu m będzie:
1 2 • rm + m3
m = mi + - • m3 =-^-
Z równania Clapeyrona dla obu naczyń (I i II) otrzymamy:
p • Vc = — • R • T P
p ■ Vc • p = m • R • T m ■ R T M “ p • Vc
/•p
/: p • Vc
Za m i Vc podstawiamy do p odpowiednie wzory. 2 • rm + nri3
R • T
Stąd p =
p • 2 • V (2 • rm + m3)- R • T 4 • p • V
Po podstawieniu do równania na ciśnienie pi otrzymamy: rm • R ■ T
P1 (2 • rm + m3> R • T 4 • p • V
V
pi = rm P1 =
4P
2 • nm + rri3
Jednostki:
_ 4 • 0,003 • 250000 P1 2 • 0,003 + 0,004
250000
_______Rozwiązania zadań ze zbioru "MF.NDLA "_
pi = 300000 Pa pi = 300 kPa
Odp.: Ciśnienie początkowe w pierwszym naczyniu wynosiło 300 kPa.
Zadanie 559 str.111
Dane:
V = 682 dm3 = 0,682 m3 mi = 12g= 0,012/cg
ti = 20°C
rri2 = 18p= 0,018kg
t2 = i oo °c
n = 28-^—. = 0,028 r mol
R = 8,31
J
mol • K
Sytuacja początkowa
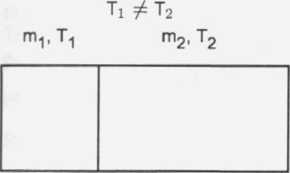
Sytuacja po wyrównaniu temperatur
Ti = T2 = T
m1,p1,T m2, p2, T
Korzystając z równania bilansu cieplnego otrzymamy:
Qp = Qo - energia cieplna Qp pobrana przez azot znajdujący się w naczyniu pierwszym jest równa energii oddanej Q0 przez azot z naczynia drugiego.
Qp = mi • c • (T - Ti) oraz Q0 = m2 • c • (T2 - T)
gdzie Ti = ti + 273K\ T2 = t2 + 273/<
Po podstawieniu do równania bilansu cieplnego otrzymamy: mi • c- (T - Ti) = 1712 • c • (T2 - T) /: c mi • (T - Ti) = rri2 • (T2 - T)
Po dalszych przekształceniach obliczymy temperaturę T jednakową dla obu części naczynia.
rm • T - rm • Ti = rri2 • T2 - m2 • T rm • T + rri2 • T = rm • Ti + rri2 • T2 T • (rm + rri2) = mi • Ti + m2 • T2 /: (mi + m2)
3 —Zeszyt 5
Wyszukiwarka
Podobne podstrony:
Image15 (37) 34 Rozwiązania zadań ze zbioru "MENDLA " 34 Rozwiązania zadań ze zbioru "
Image13 (37) 115 Rozwiązania zadań ze zbioru "MENDLAZadanie 621 str.125Dane:
Image11 (42) 76 Rozwiązania zadań ze zbioru "MENDLA" Zgodnie z przemianą izotermiczną dla
20238 Image17 (31) 123 Rozwiązania zadań ze zbioru "MENDLA " 123 Rozwiązania zadań ze zbio
57710 Image19 (31) 127 Rozwiązania zadań ze zbioru "MENDLA" Rozwiązania zadań ze zbioru
więcej podobnych podstron