Lab5 tech an gazow04

230
ciy czym: M, [j^f
P, (Pal T IK)
(6.3)
(M, R, )• 8314,3
- ciśnienie składnikowe,
- Icmpcralura mieszaniny,
Nm
- uniwersalna slnla Bazowa.
(6.4)
otrzymując wzór:
M,P r, 1%) " mrt' 100
-10
10
-J
w którym rt wyrażone jcsl w procentach, n (Mv) Jest masą molową. Jednakową dla wszystkich gazów doskonałych, tj. gazów rzeczywistych pod małym ciśnieniem.
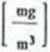
Stężenia składników szkodliwych są małe („śladowe") 1 dlatego ich masę wyraża się w miligramach mg a udział objętościowy w ppm.
Wzór łączący obie te wielkości ma postać:
s
M, • r, (ppm)
Przepisy ochrony środowiska określają wartości dopuszczalnych stężeń dla umownego m* związanego z temperaturą 0*C I ciśnieniem 760 Tr - 101,3 kPa, wtedy Jest (Mr) - 22,41 urn3 A mol. Jeżeli Jednak będą odniesione do ciśnienia 100 kPa. to wtedy będzie Mv- 22,71 umJ/kntol.
Poza produktami spalania, które są najważniejsze, gdyż ich skład świadczy o Jakości procesu spalania, interesują nas Jeszcze gazowe subslraty spalania: utleniacz i ewentualne paliwo gazowe.
Skład suchego powietrza Jcsl w przybliżeniu stały w całej troposferze - podaje go tabl. 6.1.
Głównymi składnikami są azot N} i tlen Oj. Z pozostałych gazów w większej ilości występuje tylko argon Ar - Inne gazy. w tym szlachetne: Ne. Ile, Kr. Xc nic przekraczają łącznego udziału 0,08*. Zarówno te gazy. Jak i argon, którego Jcsl w powietrzu
Tablica 4.1
|
Składnik |
NJ |
Oj |
Ar |
C°J |
Ne |
Ile |
|
Udłlal afcJtloi. d»wy wS |
78,W |
20,74 |
0,W |
0.0) |
1.8 to"3 |
5,24 I0"4 |
|
Składnik |
C,,4 |
Kr |
NO |
HJ |
Xe |
°) |
|
Wdał obJcta}. dowy w1 |
1.5 I0~4 |
1,14 I0-4 |
5 to"5 |
5 I0~5 |
8.7 to"4 |
io“‘.io"s |
0.93S są chemicznie obojętne i lak Jak azol nic biorą udziału w procesie spalania -łllsICRO ich udziały włącza się do udziału azolu, wskutek czego powietrze Jako utleniacz składa się z : 20,93 O 21 79.1 N 2, albo w zaokrągleniu: 213 02 I 793 N2.
Powietrze atmosferyczne będące zasadniczym nośnikiem tlenu do spalania zawiera Jeszcze parę wodną w iłoścl określonej przez wilgotność względną, temperaturę i ciśnienie. W dokładnych obliczeniach procesu spalania tę wilgoć powietrza należy uwzględnić, wykorzystując do tego teorię gazów wilgotnych. Teoria la ma również zastosowanie do spalin, które zawierają znaczne ilości pary wodnej II20, pochodzącej ze spalania wodoru II2, jak I z wody z paliwa. To ostatnie dotyczy przede wszystkim paliwa stałego: torfu, drewna, węgła brunatnego i kamiennego.
Pomiar wilgotności powietrza i innych gazów omówiony Jest w części 2 skryptu: -Termodynamika - Laboratorium I".
Próbka spalin, przepływając do analizatora, ulega ochłodzeniu do temperatury pokojowej, zawiera więc tylko tyle pary wodnej, ile dopuszcza nasycenie gazu parą w tej temperaturze (zgodnie z prawem Dallona: Jest to Inka ilość pary suchej nasycanej, jaka wypełniałaby całą objętość zajmowaną przez mieszaninę pr/.y temperaturze tej mieszaniny) - pozostała para ulega wykroplcnlu. Do analizatora trafia więc próbka pozbawiona pierwotnej zawartości ll20. Tym samym nic można zmierzyć tej zawartości w analizatorze.
Na ogól usuwa się również tę resztę pary z próbki spalin za pomocą pochłaniacza chemicznego, uzyskując próbkę spalin suchych, albo - Ink Jak w aparacie Orsata -zapewnia stale nasycenie parą przez kontaktowanie próbki z wodą, by zapewnić stały udział pary wodnej w mieszaninie, a tym samym stale ciśnienie składnikowe tej pary. Lliminujc to wpływ pary na wynik analizy. Wynikiem analizy Jest w każdym przypadku udział oznaczanych1 składników w spalinach suchych.
uływ»ny w analityce chemicznej wyraj „o/nac/ante1 jen równoważny okreileniu „imienenle ud/ialu w mlcu1nlnle“.
Wyszukiwarka
Podobne podstrony:
Lab5 tech an gazow05 240 f. Schemat aparatu przedstawia rys. 6.3. Wyposażony on Jest w 4 chlontce (w
Lab5 tech an gazow07 232 Paliwa gazowe sę mieszaninami gazów palnych, przede wszystkim wodoru
20338 Lab5 tech an gazow09 278 LITERATURA >. Mlmejerwikl M. (icd.): fomUry cieplne I enef
Lab5 tech an gazow06 Rozwiązanie uzyskujemy lylko wicdy. gdy znamy skład łych węglowodorów, albo - c
więcej podobnych podstron