Obraz(0 (3)

produkty wtdrn* lub ulegają przekształceniu w wyniku izomeryzacji. Izt-nl*j« mtlWoie ścisłego kierowania przebiegiem procesu 1 zatrzymywania 90 w dowolnym stadium w calu uzyskania pożądanego produktu. Analogicznym przekształceniom ulegają rowniet homo log i nitrobenzenu 1 produkty ich redukcji*
Tabela 104
Czynniki wykorzystywana w procesie redukcji
|
Czynnik redukcyjny |
Subatrat |
Produkt |
|
teisso, cynk lub cyna w środowisku kwasu solnego, siarkowego lub octowago |
nitrobenzen nitrotolueny m-dlnltrobenzen 1—nitronaftalen hydrazobenzen |
anilina toluidyny m-fenylenodlamina 1-neftyloamina anilina: |
|
wodór w obecności katalizatora |
nitrobenzen nitrotolueny nitroksyleny |
anilina toluidyny ksylldyny |
|
Siarczki, disiareski, wielosiarczki i wodoroslarczki asetali alkalicznych w Środowisku zasadowym , |
m-dlnltrobenzen nitrofenole aiobsnzsn |
m-nitroanilina aminofenole hydrazobenzen |
|
Żelazo lub cynk w Środowisku, alkalicznym Cynk w Środowisku obojętnym • (z dodatkiem CnCI* lub NH„Cl ) |
nitrobenzen nitrotolueny |
hydrazobenzen toluidyny H-fenylohydrokey— amina |
|
nitrobenzen | ||
|
w roztworze alkalicznym |
nitrobenzen |
ssobenzsn |
|
SOd w bezwodnym alkoholu |
estry wy1szych kwasów tłuszczowych |
alkohole tłuszczowa |
Redukcja nitrozwiązkdw ' w środowisku zasadowym prowadzi do uzyskania związków dwuplarSalsnlowyeh. W przypadku redukcji nitrobenzenu są Łoi asobenzen lub hydrasobenzen. Ten ostatni związek po zakwaszenie ulega wewnątrzczą a toczkowemu przegrupowaniu, co wykorzystuje sig do produkcji benzydyny. Redukcja prowadzona w środowisku-o pil B-iO umożliwia otrzymanie hydrokayloamln aromatycznych.
Jeżeli związek poddawany redukcji sawlera więcej nlft jedną grupą nitrową, produkty reakajl zaletą od rodzaju wykorzystywanego czynnika redukcyjnego. Redukująo m-dlnitrobenzen można utyakad m-nitroaniliną lub m-fenylanodiaminąi
Z zestawiania czynników redukcyjnych w tab. 104 wysika, ta wodcr jest jednym z licznych czynników, ktOre stosuje slą w procesie redukcji, w odróżnieniu od innego procesu — uwodornienia - który prowadzi się wyłączni# przy wykorzystaniu wodoru. Poniowai proces redukcji molo byO mylony z procesem uwodornienia, przedstawiono przykładowe reakcjo (wykorzystujące podobno surowca, choC przebiegająca w rolnych warunkach), ktOrs ilustrują rOtnics pomiędzy oboma procesami i
Procesy redukcji
1) metanizacja gazu syntezowego ł
Procesy uwodornienie synteza metanole z gazo syn-
1)
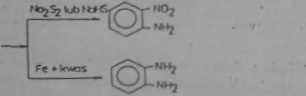
Proces redukcji prowadzi sig z zastosowaniem rOtnorodnych związków chemicznych o właściwościach redukcyjnych lub elektrolitycznie (tab. 104). O rodzaju produktu otrzymywanego w wyniku redukcji nitro związków decyduje nie tylko rodzaj substancji redukującej, ale równie! pH Środowieke reakcyjnego, kadukująe nitrobenzen za pomocą cynku i odpowiadało regulując kwasowość Środowiska solna otrzymać następujące produktyt
NO,
co • 3 H,
CH„
MjO
2) redukcja estru kwasu karboksylowego do alkoholu i
RCOOCH, ♦ 2 H, —*
-» RCHa0M • CHa0H
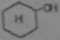
3) redukcja fenolu do bonzenu
CM, OM
2) uwodornienia aldehydu do •lkoholui
RCMO
Ł Hj
RCM,0M
3) uwodornienie fenolu do cy-klohekaanolui •
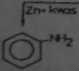

*04
dkotio
Ma jenergiczniej przebiega redukcja nltrozwlązków metalami w Środowisku kwaśnym, końcowymi produktami I tym przypadku są aminy plerwszorzgdowe.
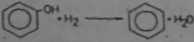
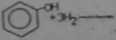
Z podanych przykładów wynika, to reakcjo uwodornienia mają charakter przyłączenia (brak produktów ubocznych), natomiast redukcji towarzyszy eliminacja heteroatomu z cząsteczki. Podczas uwodornienia następuje wzbogacenie cząsteczki w atomy wodoru* natomiast podczas redukcji cząsteczka moie alg wzbogacać w atomy wodoru, sla nic musi.
ISf
Wyszukiwarka
Podobne podstrony:
CCF20090327�002 Operacja symetrii (przekształcenie symetryczne) - taki ruch przedmiotu lub jego prze
DSC05255 Bioetanol • etanol produkowany z biomasy i/ lub ulegającej biodegradacji&
Niektóre naturalne metabolity też ulegają przekształceniu w wyniku giuiaironioac/i np/.
Hydrolizaty białkowe Produkcja hydrolizatów białkowych odbywa się w wyniku enzymatycznej lub kwasowe
Ustawa z dnia 14.12.2012 r. o odpadach - PRODUKT UBOCZNY Przedmiot lub substancja, powstająca w wyni
DSC06598 Definicje Środki spożywcze - powstałe w wyniku procesu produkcyjnego to produkty spożywcze
dalszym podziałom, a jego rezultatem jest produkt, usługa lub istotna decyzja. W strukturze modułowe
Zdjęcie014 Weryfikacja tulei h> • Tuleje ulegają zużyciu w wyniku ścierania,
IMGg13 (2) środowisko „ogół elementów przyrodniczych, w tym także przekształconych w wyniku dzi
więcej podobnych podstron