skan0281

284 Elektrochemia
dla kilku molalności m w temperaturze 25°C wynosi
|
m ■ 103 [mol • kg l] |
123,8 |
25,63 |
9,138 |
5,619 |
3,215 |
|
E [mV] |
341,99 |
418,24 |
468,60 |
492,57 |
520,53 |
Obliczyć: a) standardową SEM tego ogniwa, E°, b) średnie współczynniki aktywności HC1 w tych roztworach, c) pH roztworu o m = 2,563 • i O-2 mol • kg-1.
Rozwiązanie, a) Na elektrodach tego ogniwa przebiegają reakcje, których suma daje reakcję ogniwa
- : \ H2 ^ H+ + *?,
+ : AgCl + e ^ Ag + Cl-,
^H2 + AgCl = H+ + Cl" + Ag.
Zgodnie z nią SEM ogniwa opisuje równanie Nernsta
E = E°-
RT
F
ln«H+tfC1- = E° -
2 RT F
ln a±,
gdyż aAg, «AgCi i fu2 s4 równe jedności, a dla roztworu HC1
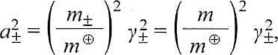
gdzie = 1 mol • kg-1. Dla tak małych wartości m gęstość wodnego roztworu HC1 jest bliska 1,000 g ■ cm-3 i nietrudno sprawdzić, korzystając ze wzoru (4.8). że c = m, a zatem, dla elektrolitu 1-1,7 = m. Teoretyczny średni współczynnik aktywności dla najmniejszego stężenia obliczono korzystając z granicznego prawa Debye’a-Huckla (6.37), dla pozostałych - z prawa Debye’a-Hiickla (6.39). Wyniki obliczeń pokazano w tab. 6.5.
Tabela 6.5
|
m ■ 103 [mol • kg-1] |
\7 |
ig y± |
y± teoret. |
a± |
ln a± |
E [mVJ |
y± dośw. | |
|
3,215 |
0,05670 |
-2,2887 • JO-2 |
0,936 |
3,008 • |
10"3 |
-5,8064 |
520,53 |
0,936 |
|
5,619 |
0,07496 |
-3.550 • 10-2 |
0,922 |
5,178 • |
ur3 |
-5,2633 |
492,57 |
0,923 |
|
9,138 |
0,09559 |
-4,442 • 10-2 |
0,903 |
8,250 • |
io--3 |
=1.7976 |
468,6 |
0,905 |
|
25,63 |
0,16009 |
-7,026- 10"2 |
0,851 |
2,180 • |
io-2 |
-3.8258 |
418,24 |
0,860 |
|
123,8 |
0,35185 |
-0,1325 |
0,737 |
9,125 • |
10"2 |
-2,3942 |
341,99 |
0,785 |
Wyszukiwarka
Podobne podstrony:
skan0281 284 Elektrochemia dla kilku molalności m w temperaturze 25°C wynosi m ■ 103 [mol • kg
skan0281 284 Elektrochemia dla kilku molalności m w temperaturze 25°C wynosi m ■ 103 [mol • kg
31268 spektroskopia017 34 Rys. 12. Krawędź absorpcji w obszarze przejść skośnych dla kilku różnych t
Zadanie 6. (0-1) Napisz równanie reakcji hydrolizy fosgenu. Zadanie 7. (0-2) W temperaturze 25 °C i
ch8 Matura Arkusze chemiiW65406 Zadanie 8. (1 pkt) W dwóch probówkach znajdowała się woda destylowan
119 2 px =0,1 MPa, dla którego objętość właściwa wrzącej wody wynosi 0,001 m3/kg, ma wartośćh,2 = Pl
05 3 Zadanie 7 Zadanie 8 □ Prężność pary Hg w temperaturze 290 °C wynosi 26,30 kPa a w temper
P1160490 Tabela 2 Gęstość niektórych cieczy w temperaturze 20 °C Nazwa cieczy Gęstość kg/m3 Nazwa
Elektronika Dla Wszystkich 09 > <-o o s o »TouchPad do PCOśla taczka - regulatory temperatury
skan0277 280 Elektrochemia z którego można łatwo obliczyć wartość A. Dla wody w 25°C statyczna przen
Image8 (25) _A__A__A_Projekty AVT ■ Rys. 1 Schemat ideowy W Elektronice dla Wszystkich zamieszczono
31199 skan0277 280 Elektrochemia z którego można łatwo obliczyć wartość A. Dla wody w 25°C statyczna
więcej podobnych podstron