skanuj0017 (158)

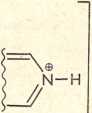
2. Zasady heterocykliczne reagują z kwasem nadchlorowym w myśl następującej reakcji:

CI04e + CH3COOH
N + CHaCOOHj® CI04
3. Sole amin, zasad heterocyklicznych i sole amoniowe.
Większość soli w zależności od rozpuszczalnika wykazuje wyraźne cechy kwasu lub zasady [169]. Do oznaczeń ilościowych środków leczniczych będących solami wykorzystuje się najczęściej właściwości zasadowe anionu, który przyjmując proton przechodzi w kwas. Sole zawierająpe~apion organiczny mogą być miareczkowane bezpośrednio kwasem nadchlorowym:
C—®e
+ CH3COOH® CIO®
H-C-OH H—(I—OH
l/>
C—OH
V
N—H
Bezpośrednio mogą być oznaczane takż
azotany, azotyny, fosforany i siarczany zasad organicznych. Jon siarczanowy w środowisku kwasu octowego może*, przyjąć tylko jeden "proton i dlatego zużywa tylko 1 mol kwasu nadchlorowego, co odpowiada przejściu jonu SO|~ w HS04. Przyjęcie drugiego protonu przez jon HSQ4 nie jest już możliwe, ponieważ kwas siarkowy w środowisku kwasu octowego jest jednym z najsilniejszych kwasów i dlatego w stosunku do kwasu nadchlorowego ma bardzo słaby charakter zasadowy.
Także jony chlorowcowodorowe w środowisku kwasu octowego mają bardzo słaby charaktet_zas&dowy w stosunku do kwasu nadchlorowego i nie są zdolne do przyjęcia od niego protonu. Z tego względu nie można oznaczać soli zasad organicznych z kwasami chlorowcowódorowymi przez bezpośrednie miareczkowanie kwasem nadchlorowym. Należy je uprzednio przeprowadzić w.octany działaniem octanu rtęciowego w 100% kwasie octowym [170].
|
- H - |
© |
r H 1 1 |
© | |
|
2 |
_R—NH2_ |
Cl© + (CH3C00)2Hg —* |
, 1 _R—NH2_ |
CH3COO© + HgCI2 |
304
Wyszukiwarka
Podobne podstrony:
img068 (11) 2. Zasady heterocykliczne reagują z kwasem nadchlorowym w myśl następującej reakcji: N +
skanuj0015 (180) kwasem nadchlorowym po przekroczeniu punktu równoważnikowego stężenie powstałego na
skanuj0014 (158) I • ) Cf CĆyO £M7oy f- h ) d w.- ,y C
skanuj0020 (158) • -rv TT 200 Rozdział 6. Język i mass media: znaczące płaszczyzny komunikacji ofice
skanuj0021 (158) - ?zij<ru>ajy [tosA-W^f/ CMZftrjnpj oyaflo*^ ćk/acfafe -
skanuj0022 (158) MONETY OBIEGOWE PO DENOMINACJI OB 248 2 ZŁOTE NOC ŚWIĘTOJAŃSKAOB
więcej podobnych podstron