skanuj0004


Obraz elektroforetyczny rozdziału Izoenzymów LDH obecnych w surowicy człowieka zdrowego oraz densytometryczna ocena zawartości poszczególnych frakcji. W obrazie dominują pochodząca z mięśni szkieletowych frakcjo L0H1 i LDH2
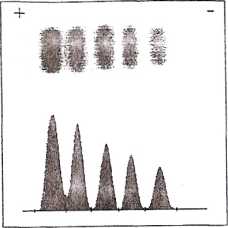
Obraz elektroforetyczny rozdziału izoenzymów LDH obecnych we krwi chorego w trzeciej dobie po zawale mięśnia sercowego. Zwraca uwagę znaczne podwyższenie całkowitej aktywności LDH oraz wzrost lecenzymu LDH1, który staje się największą frakcją LDH we krwi
według: diagnostyka laboratoryjna z elementami biochemii klinicznej”, red. A. Dembińska-Kieć, J. Naskalski, Urban&Partner, Wrocław 2005.
W tkankach człowieka występują wszystkie rodzaje tetramerów LDH. Wzajemne przekształcenia pirogronianu i mleczanu są możliwe dzięki różnym właściwościom katalitycznym izoform LDH w różnych tkankach. In vitro izoenzym LDH-1 wykazuje niskie Km względem pirogronianu i jest silnie hamowany przez wysokie stężenia tego metabolitu. Na podstawie tych danych można sądzić, iż LDH-1 związana jest z tkanką o dużych wymaganiach tlenowych (np. serce), a jej głównym zadaniem jest utlenienie mleczanu do pirogronianu. Z kolei LDH-5 wykazuje wyższą wartość Km względem pirogronianu i jest mniej wrażliwa na wysokie stężenia pirogronianu niż LDH-1. Ten izoenzym może więc pracować w warunkach beztlenowych, w których syntetyzowany jest kwas mlekowy. Jednak obecność tych samych izoenzymów w tkankach o różnym profilu metabolicznym, np. LDH-1 w sercu i erytrocytach, a LDH-5 w wątrobie i mięśniach, utrudnia precyzyjne określenie ich roli fizjologicznej.
Znaczenie LDH w diagnostyce
W surowicy ludzi zdrowych przeważa izoenzym LDH-2. Podczas zawału serca z uszkodzonych kardiomiocytów uwolniony zostaje izoenzym LDH-1, w surowicy wyraźnie rośnie jego aktywność. LDH-1 ma spośród wszystkich izoform najdłuższy okres półtrwania - 100 godz. (podczas gdy dla LDH-5 okres ten wynosi tylko 10 godzin). Wynikiem tych zmian jest odwrócenie proporcji ilościowych obu izoenzymów.
Dodatkowo LDH-1 utlenia także a-hydroksymaślan do oksymaślanu. Próba ta określana jest jako HBDH. LDH-1 z kardiomiocytów wykazuje większe powinowactwo do maślanu niż do mleczanu.
Wyszukiwarka
Podobne podstrony:
79409 strona (170) (poza burzami elektrycznymi) nie przekraczają możliwości przystosowania i toleran
(1) Rozdział elektroforetyczny białek. Izoenzymy. Wstęp. Ełektfofefcza. Jedną z nąj
Rozdział 1 domyślnie wyłączona. Aby zmienić ustawienie opcji Podgląd dla przycisku Skanuj obraz (0),
skanuj0011 (182) 37 Rozdział 3. Żywienie dzieci Tabela 3.3. Aktualny (2007) schemat żywienia niemo
więcej podobnych podstron