SL371950
CzfśćIH - 70 min
Proszę każde zadanie pisać na oddzielnej kartce
NTa kązdei_kartce należy napisać nazwisko i numer zadania
(T^roszę opisać reakcjami obserwowane efekty.
A. roztwór jonów Ni(II) po dodaniu amoniaku staje się intensywnie niebieski
Po wprowadzeniu kwasu solnego zabarwienie zanika.
[B/roztwór jonów Cu(II) po dodaniu amoniaku staje się intensywnie niebieski, ro wprowadzeniu kwasu solnego zabarwienie zanika.
półreakcji proszę zestawić reakcję redo-oks między jonami SCN‘ a utleniaczem:
SCK + 4K20 = SO< +CN* + 8IT + 6e
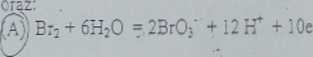
(B) er + 3HjO = CI03' + 6H* + 6e
i/---
3. Naszkicuj reakcjami wykres E-pH wg równan:
2n + 2 e — Hj Oj + 4H* + 4e = 2HjO
-0,059 pH +1,22-0,059 pH
oraz (A)
Mg = Mg* + 2e
Mg + 2H20= Mg (OH)? + 2e
- 2.363V • 1,S62- 0,059pH
-1,179 V
Mn + 2H:0 - Mn (OH)2 -f 2H" - 2e -0,727 - 0,059pH Proszę skomentować własności kadmu (A) lub kobaltu (B) a w szczególności: zachowanie sie metalu w środowisku kwaśnym^ obojętnym i zasadowym, możliwość reakcji metalu i kationu z wodorem i tlenem (rozpuszczonymi w wodzie)
4. Naszkicuj reakcjami wykres E-pH wg równan:
2H* + 2e =Hj 0j + 4Hfł + 4e = 2H20
-0,059 pH +1,22- 0,059 pH
-2,031 V
/
Wyszukiwarka
Podobne podstrony:
75997 SL371939 CzęśćDI - 70 miń Proszę każde zadanie pisać na oddzielnej kartce Na każdei kartce nal
13287 SL371954 CzęśćIII - 70 min Proszę każde zadanie pisać na oddzielnej kartce Na każdej kartce na
P2251742 Częśćffl - 70 min Proszę każde zadanie pisać na oddzielnej kartce Na każdej kartce należy n
P2254153 jA 3 *1 Cześ clii -70 min Proszę każde zadanie pisać na oddzielnej kartce Na każdej ka
P2252754 Część n - 100 min 15 min przerwy , Proszę każde zadanie pisać na oddzielnej kartce&nbs
P2255827 aJq Część U - 100 min 15 min przerwy j Proszę każde zadanie pisać na oddz
14571 SL371888 Cześć I -100 min 15 min przerwy Proszę każde zadanie pisać na oddzielnej kartce Na ka
SL371894 X. Pierwsza cześć - 60 min 15 min przemy druga cześć - 60 min Proszę każde zadani
SL371933 v Część U - 100 min . 15 min przerwy i Prószy każde zadanie pisać na oddzielnej kartce Na k
P2252551 Czese I - 100 min 15 min przerwy Proszę każde żaganie pisać na odazisinei kartce
egzamin2 Proszę niczego nie pisać na tej kartce I zad. L Dany jest rysunek nr 1. Wartość obciążenia
więcej podobnych podstron