str15 (37)


Metody miareczkowe wykorzystujące reakcje redoks. Reakcje redoks polegają na wymianie elektronu pomiędzy czynnikiem redukującym (reduktorem) oddającym elektron, a czynnikiem utleniającym (utleniaczem) przyjmującym elektron
Reduktor utleniacz + elektron
Do metod redoksymetrycznych należą: manganometria, jodometria, bromianometria, cerometria, chromianometria
• Reduktometria - miareczkowanie roztworami reduktorów,


• Oksydymetria - miareczkowanie roztworami utleniaczy,
Dr Stanisław Walas Zakład Chemii Analitycznej UJ

Dr Stanisław Walas
Reakcje utleniania i redukcji
red1 -5 Utl., + utlenianie^
utl2 + n2e tir red2 redukcja -*
przebiegają w układach sprzężonych.
Dla reakcji sprzężonej mamy więc:
n2red1 + n^tlg ^ n2utl1 + n1red2
W reakcjach redoks obok bilansu masowego należy również przeprowadzić bilans ładunków
Reakcje redoks na ogół przebiegają wolniej niż reakcje zobojętniania
Zakład Chemii Analitycznej UJ
i
Redoksymetria
Podstawowe zagadnienia i terminy
■•^Stopień utlenienia,
Potencjał redoks
^'Charakterystyka aktywności układów redoks, ^Wpływ pH na przebieg reakcji redoks, c:>Wpływ reakcji kompleksowania i wytracania osadów na potencjał redoks,
^Uzgadnianie reakcji redoks,
r Dr Stanisław Walas
Zakład Chemii Analitycznej UJ


Stopień utlenienia
' % Pilili'
Pojęcie formalne przyporządkowujące ładunki elementarne atomom tworzącym wiązania chemiczne w cząsteczkach lub jonach. Zakłada się że:
* stopień utlenienia pierwiastka w stanie wolnym jest równy zeru,
• suma stopni utlenienia pierwiastków tworzących obojętna cząsteczkę jest równa zeru,
♦ suma stopni utlenienia pierwiastków tworzących jon jest równa ładunkowi jonu.
Dr Stanisław Walas
Zakład Chemii Analitycznej UJ
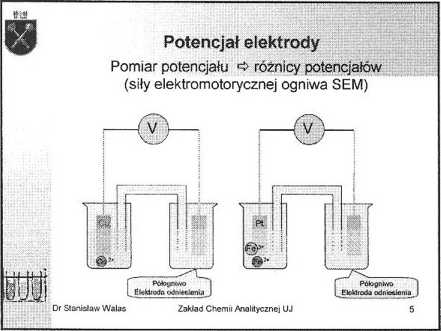
Charakterystyka układów redoks
Wielkością charakteryzującą układ red/utl pod względem własności redoks jest jego potencjał redoks.
Zgodnie z wzorem Nernsta
E = E°- — ln ~ lub
nF
a..
£ = £"+--In-nF i

Dr Stanisław Walas
w którym:
E°- potencjał standardowy danego układu redoks,
R - stała gazowa (8,314 J/(Kmol)), T - temperatura bezwzględna (K), n - liczba elektronów biorących udział w reakcji, F - stała Faradaya (96490 C/mol), a^, i aled aktywności form utlenionej i zredukowanej danego układu.
Zakład Chemii Analitycznej UJ
Wyszukiwarka
Podobne podstrony:
Zdjęcie0892 Reakcje chemiczne wykorzystywane w analizie miareczkowej W analizie miareczkową wykorzys
METODY SPEKTROFOTOMETRYCZNE BIURETOWA - wykorzystuje reakcję zachodzącą w środowisku zasadowym pomię
dscn4034 Reakcje chemiczne wykorzystywane w analizie miareczkowej W analizie miareczkowej wykorzystu
DSCN4163 Miareczkowanie kompleksometryczne wykorzystuje reakcje z użyciem w charakterze titrantu
3. Rodzaje analizy w JST 2 4. Metody analiz wykorzystywane w analizie finansowej JST 2 5. Metody
img063 63 Rozdział A. Nieliniowe sieci neuronowe klasycznej metody backpropagalion z wykorzyslniem e
img063 63 Rozdział A. Nieliniowe sieci neuronowe klasycznej metody backpropagalion z wykorzyslniem e
IMGD48 > Metody organoleptyczne - wykorzystuje się smak i zapach substancji >
5.2. Zastosowania nowoczesnych metod TI. 6. Metody prezentacji z wykorzystaniem technologii
slajd15 (176) EKSPLORACJA DANYCHZadania eksploracji danych: przewidywanie Wszystkie metody i technik
fizyczna2 45. Kinetyka formalna 46. Metody pomiaru rzędu reakcji
Nr: 20 Metody obliczeniowe - Budownictwo semestr 2 - wykład nr 1 Metody bezpośrednie - wykorzystanie
3.4 Zastosowanie energii odnawialnej w budynkach Metody pasywnego wykorzystania energii słonecznej
5 48. JAK uczyć gramatyki w gimnazjum? : propozycja metodyczna lekcji z wykorzysta
więcej podobnych podstron