Obraz!4 (7)


SOjH
- -83.5 kJ/mol{
I
Kw«» benzenosulfonotry c,Mtso,M bezwodny jest substancje krystalicznej o temp. topn. 66°C. W postaci wodsiana C«H,S03h | H,G topi sio w te"PT 44°C. Jest substancją higro.skoplji»e. bardzo dobrze rozpuszczalne w wodzie. Dawniej stanowił ważny produkt poiredni w syntezie fenolu ■etodeS 'sulfonacy jne~. H ostatnich latach metoda ta traci na znaczeniu};
Sulfonowanie kwasu benzenosulfonowęgo za powocę ol*Ub| otrzymanie kwasu a-benzenodisulfonowego, któryj półprodukt w procesie otrzymywania rezorcyny! »
5Of* »OWa qm 1
(p. 4.24). umożliwia
JSHI.I stanowi, fi i


— :‘OHa _ ___
Rezorcyna (m-dlhydrokaybenzen) *3#st bezbarwne, krystaliczne substan-j
cje o słodkim smaku i temp. topn.:110°C. Stanowi półprodukt barwnikar-
ski.w lecznictwie irodek przeciw egzemie, a w przemyśle drzewnym wyko-|
czystaje się polikondeneaty rezorcyny z formaldehydem jako kleje..
Światowa produkcja rezorcyny w 1986 r. wynosiła 40 tys. t.
Nitrowanie benzenu

HŃQj
Na anilinę przerąbie aię W akali Światowej ok. 90-95% produkowanego nitrobenzenu.
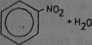
filtrowanie benzenu mieszaninę o składzie: 32-39% HNOa, 55-63% M,SOk i 8% Ha0 w temp- 50-55°C umożliwia otrzymanie nitrobenzenu:
Ali—117 kJ/mol
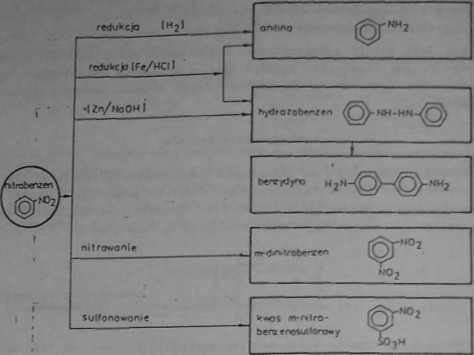
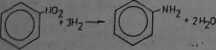
Nitrobenzen CaHaNOa jest oleiste, jaanożólte ciecze O zapachu migdałów, o temp. topn. 5,7°C 1 temp. wrz. 210°C. Bardzo słabo rozpusz-j cza się w wodzie. Jest lotny z parę wodne- Wykazuje wlaSciwoSci trujeęej zarówno przy wdychaniu, jak i przez skórę. Nitrobenzen wykorzystuje iłęi jako rozpuszczalnik lub Środowisko reakcyjno np. dla reakcji Friedla-j Craftsa z udziałom katalizatora AICIa > Stanowi półprodukt barwnikarski, I środków ochrony roSlin i farmaceutyczny (rys. 132). Najważniejszym jed-l nak kierunkiem przerobu nitrobenzenu jest jego redukcja do aniliny, np'. za pomoce wodoru:
Ali—443 kJ/mol
Rys.'132. Kierunki wykorzystania nitrobenzenu w syntezie organicznej
Anilina C*H*NHa jest oleiste, bezbarwne ciecze o charakterystycznym zapachu. Na powietrzu i pod wpływem Światła brunatnieje. Topi aię w temp. r6°C, a wrze w temp. 104°C. Anilina l joj pary działaje trujeco. niszczeć czerwone ciałka krwi (wchłania aię przez skórę). Jest lotna z parę wodne- Grupa —NHa w anilinie wykazujo doS6 duże reaktywność, co wykorzystuje się w syntezie związków przedstawionych na rys. 133. Pochodne aniliny stanowię Środki lecznicze, barwniki, pestycydy, materiały wybuchowe,, środki pomocnicze dla przemysłu gumowego (antyoksydanty, przyspieszacze wulkanizacji). Największe iloSC aniliny przeznacza się do przerobu na 4,4'-diaraŁnodifeny1ometan (w reakcji kondensacji z formaldehydem), który przerabia się następnie na 4,4*-dllzocyJanlanodlfeny-lometan (tab. 80)i ...
MOI
427
i
426
Wyszukiwarka
Podobne podstrony:
Obraz (1793) 164 Zmierzone ciepło uwodornienia benzenu wynosi tylko 209 kJ/moł, jest więc o 151 kJ/m
Zdjęcie0564 (2) Entalpia rozpuszczania związków jonowych v/ temp. 25°C dla rozcieńczonych roztworów
skan0329 332 Elektrochemia AG298 = -350 kJ • mol’1; z1S = -51,14 + 0,4979F; AS29% = 97,23 J • K_1 •
egzamin chemia ogólna�8 17. Wydajność reakcji chemicznej: 2 N02 = N204 AH° = -61 k
IMAG0080 glukoza + P
IMAG0385 (3) > efektywność działania katalizatora Energia rozkładu H2O2 Katalizator Ea (kJ/mol)
Scan0003 FOTOSYNTEZAA intensywność absorpcji światta [kJ/mol]fotosynteza 250-chlorofil a / 170Bchlor
więcej podobnych podstron