P5101340
Efekty cieplne reakcji
Ładq przemurur ttacmrenej towarzrszy okredooy efekt cieplny Można go określić jako ilość energii wyżcniomi w postaci depta między układem a otoczeniem. W przemianie izochon cznej (tzn. w stałej objętości 11 przemianie iznhaiycznej (tzn. pod stałym ciśnieniem) elekt cieplny jest równy zmianie funkcji MM (odpowiednio energii wewnętrznej reakcji i entalpii reakcji). Efekt cieplny jest więc niezależny od .drop' przrmam.a jedynie od stanu początkowego i końcowego układu ■ przenunk izotennicziKHZobarycznet efekt cieplny jest równy zmianie entalpii układu AH. Entalpię reakcji podaje się w (y/mol).
Proces endoenetgetyczny:
|
energia |
energia |
■irh/i |
|
▼ llKlaU _/ |
Proces egwneigetyczny
układ
J L
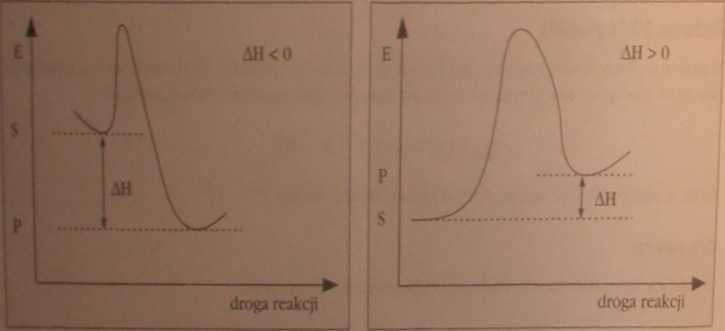
Umownie przyjęto, że gdy AH < 0, to przemianie towarzyszy przepływ energii (ciepła) od reagentów do otoczenia (przemiana egzoenergetyczna), a gdy AH > 0, to energia (ciepło) z otoczenia jest pochłaniana przez reagenty (przemiana endoenergetyczna). Efekt cieplny przemiany zależy od temperatury i ciśnienia, w jakich zachodzi reakcja.
Jako indywidualna cecha przemiany, AH zależy również od ilości substratów i produktów i ich stanu skupienia Tzn! równanie termóchemiczne zawiera informacje o stanach skupienia wszystkich substratów i produktów, ich odmianach krystalograficznych oraz efektach cieplnych, np.
CH^+20^
AH° = -686 kj/mol CH(
W tablicach termochemicznych podaje się zwykle standardowe efekty cieplne AH" reakcji, czyli dla warunków określonych temperaturą 25 °C = 298,15 K i ciśnieniem 1,013 • 10’ Pa. Zazwyczaj dotyczą one procesu spalania i tworzenia:
146 NtnMn-cheali
motow* entalpia spolinU to cnulpa rcafccu cńkowitess* spńciro i ok4*
kM dKnnnc^v pnrhie^»Hij w wwiDbcfa standardowych Produktm mfccfr ss (tumCKL >WP i mnHmltuc SO.Iub subsancjc proste (np N.,0^_
j SnSardowsi tnabw* entalpia wonenU (AłT^) to entalpia mktii svrftcr\ l tó mvk« <he warp' i pltniiabw w postaci trwalej » wwintach s&ndardow-ych SwMntT entalpie I j pjmvvvs\co\v w stanic wolnym są równe cero.
f akrofo od todaajwtypu przemiany. do której elekt cieplny -4ę odnosi, istnieje u'\\rcc: np ciepło Nąwsaccania. ciepło zobojętniania, ciepło hydratacji.
Ckpkimli« chaińcznej - w adeżnosei od podanej iednosaki - odnosi się doScahv whstmulub produktu pedwd « mniuniu stechiometr>x-*nym (ątodnwśc ze w-społciynnikicm swchtometiYcnwnń tub mc np
Hw + ^0^-*. H,0^ AH* = -242 kj/mol
2H*» + °a« -► 2Ha°w AH*«-4»4«
pnwo Lavołskra-Laplace'a efekt cieplny danej reakcji i efekt cieplny reakcji przebiegającej w kierunku pnedwnym różni się tylko znakiem.
Jeżeli dla reakcji: A + B = C efekt cieplny wynosi AH* = -15 kj/mol. to dla reakcji ptzchirgafrcct w kie radni odwrotnym: C = A + B wynosi AH° =15 kj/mol
Prawo Hessa: niezależnie od tego, czy reakcja chemiczna przebiega od stanu początkowego vk> >umi końcowego bezpośrednio czy przez reakcje pośrednie, całkowity efekt cieplny reakcji jest w obu przy pidkach taki sam.
Założono, że wszystkie procesy muszą zachodzić w ustalonych warunkach izotermiezno-uoUarycmych lub tootermiczno-izochorycznych.
rr_ etap pośredni
stan początkowy - - --► s,an końcowy
1*«J
AH, = AH, + AH,
Efekty cieplne reakcji można obliczyć, korzystając z prawa lavolsicra-Laplace';» ora. prawa Hessa Prawa tc wykorzystuje się do wyznaczenia nieznanych elektów cieplnych reakcji chemicznych na podstawie innych reakcji, dla których znane są efekty cieplne.
Podczas rozwiązywania zadań łączymy poszczególne równania chemiczne (dodajemy stronami, odejmujemy stronami) tak. aby otrzymać równanie tej reakcji, której elekt cieplny Uczymy Tc manipulacje matematyczne, które zostały dokonane na równaniach reakcji, należy w następnej kolejności wy konać na wartościach ciepht poszczególnych reakcji chemicznych (dodać,odjąć, podzielić) Vi ©bitez.cniach można również wykorzystać stabelaryzowane wartości standardowych molowych entalpii tworzenia oraz stan-dirdowych molowych entalpii spalania (dla substancji organicznych) zgodnie z poniższymi wzorami:
*>
= SCP.AHy^, - scn.AHy^,__
r (sigma) - symbol sumy (dodawania) określonych składników n - współczynniki stechiometryczne występujące w równaniu terraoćhcmicznytu
Energia wiązania chemicznego to energia potrzebna do rozerwania wiązania t ty m sann m energia uwal-niana przy jego tworzeniu.
Wyszukiwarka
Podobne podstrony:
Sprawozdanie 1 z dnia 23 XI 2014r. Bartłomiej Ślęzak Adam Witnik 32) Efekty cieplne w reakcji chemic
Prawo to pozwala obliczać efekty cieplne reakcji i przerriianchemieznyeh według zależności 111111H*
reakcji jądrowych Zmiany masy ogrzewanej próbki Termo grawimetria (TG) Efekty cieplne (związane
skanuj0001 Doświadczenie . Efekty cieplne rozpuszczania Do czterech małych probówek wiej około 2 cm&
WYKŁADY EFEKTY ROZPUSZCZALNIKOWE W REAKCJACH RODNIKOWYCH S01-W07 Grzegorz Litwinienko* *Uniwersytet
DSC04261 Promieniowanie nodnen-one - 790 -1000 gig Dają efekty cieplne. Przenikając w Kłąb tkanek po
DSC04273 metylenowy. Promienie mikrofalowe Zawarte między podczerwienią a lalami radiowymi. efekty c
Slajd74 DIATERMIA Efekty cieplne w tkankach, wywołane przepływem prądów wysokiej częstotliwości
Sytuacyjne teorie kierowania Efektywność stylu kierowania zależy od warunków towarzyszących (np.
3. Rodzaje prądu elektrycznego 15 nia prądu stałego, powodującego takie same efekty cieplne. Na przy
P5101302 MHwtS Rowtumc reakcji chenac/nci: ( 9n§ 12 KMno CtHCOOK 4~2MaO, + KOH -hif,0 (Sans
więcej podobnych podstron