S0009 (2)
I Solnktywiii) tworzonio wigzań węgiel węgiel
O
O
COOR
|
1 (\ |
-A |
^■CN |
/CHO | |
|
i |
NH | |||
NO
O
l>
O
Ph
13
14
15
COOR
16
17
11 !ikiyXv *1 * czteropodstawionym wiązaniem C=C wykazują znacznie obniżo-
{'Vkl();,, fćw 'cakcji Dielsa-Aldera.
k,Ur|V(V' ('-Vcja furanu i maleimidu w temperaturze 25°C prowadzi do produk-" ,Vc/i1y "c^<) ° konfiguracji endo-18; w wyższej temperaturze (90°C) produkt / '■ Ke- P1 kształcą się w produkt termodynamicznie trwały 18 (schemat 1 vei*t furanu z bezwodnikiem maleinowym jest opisana w podrozdziale
s
+
13
25°C
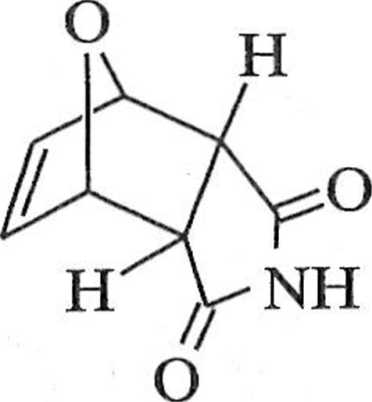
endo-18 Schemat 1.1.7
O
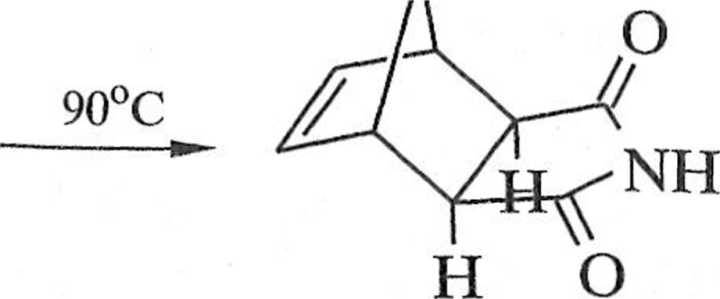
egzo-18
Schemat 1.1.8
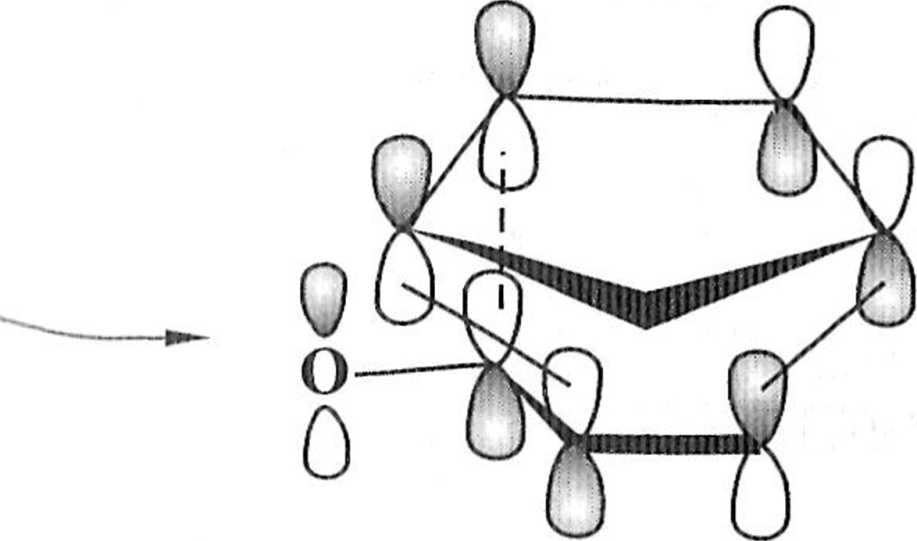
v;iii S(( - Schematu wynika, że nowe wiązania <j tworzą się na skutek oddziały-M/vk|^i łl*llejhlnych. Tłumaczy to preferencję endo w reakcji cyklopentadienu na
A ;iki*oleiną |3|.
Reakcja Dielsa Aklera ma wiele cech korzystnych dla zastosowań syntetycznych.
I. Jest efektywna pod względem atomowym: wszystkie atomy substratów pozostają w produkcie.
W produkcie reakcji może być generowanych jednorazowo do czterech centrów chirałności, a wysoka stereoselektywność reakcji umożliwia kontrolę konfiguracji produktu (absolutnej i względnej).
Reakcję Dielsa-Aldera można katalizować kwasami Lewisa (również chiralny-mi) [4, 5]. Na szybkość reakcji (oraz selektywność) ma również wpływ temperatura, ciśnienie, a niekiedy nawet charakter rozpuszczalnika (np. użycie wody) [6].
W przykładzie przedstawionym na schemacie 1.1.9 reakcja hetero-Dielsa-Aldera w roztworze wodnym między (is,E)-heksa-2,4-dienern (19) a jonem iminiowym 20 jako dienofilem prowadzi do tylko jednego cA-diastereoizomeru pochodnej iclrahydropirydyny 21 [7] (schemat 1.1.9).
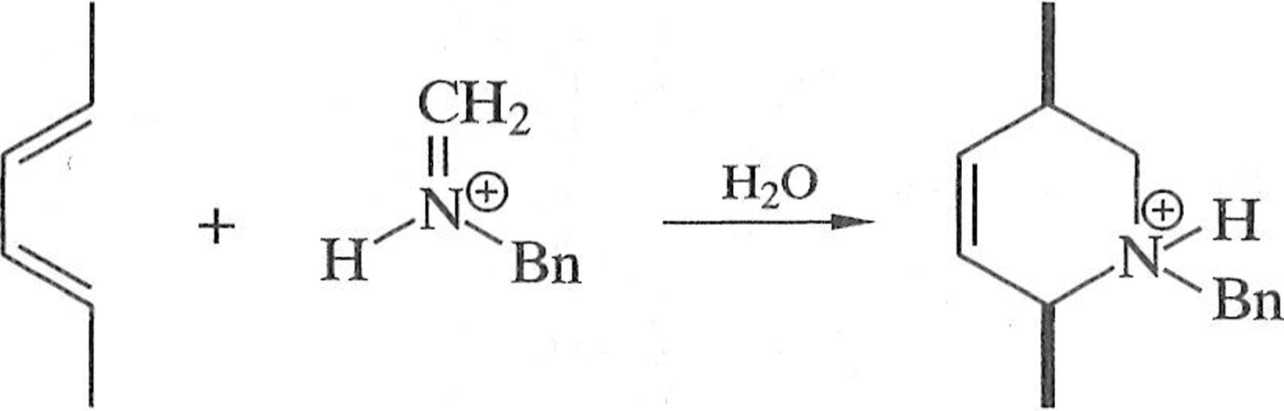
19 20 21
Schemat 1.1.9
W opisanych niżej eksperymentach dienofilem jest wysoce reaktywny bezwodnik kwasu maleinowego (12), jako dieny zaś stosowane są cyklopentadien (I), 2-naftol (4) i l,4-difenylobuta-l,3-dien (24) (schemat 1.1.10).
W przeciwieństwie do reakcji cyklopentadienu (1) z 12, której produkt 22 ma konfigurację endo, addycja furanu (5) do 12 daje produkt o konfiguracji egzo (patrz rozdział 9).
Asymetryczna reakcja Dielsa-Aldera umożliwia generowanie centrów chiral-i u >ści w produkcie cykloaddycji i ma ogromne zastosowanie w praktyce syntetycznej 18-11].
Indukcja asymetryczna może być uzyskana na dwa sposoby: użycie chiralnego katalizatora typu kwasu Lewisa, np. chiralnej oksazaboroli-dyny Coreya | Ib, I 2| (schemat 1.1.11);
użycie chiralnego reagenta: dicmi lub dienofila. Najczęściej (ze względów praktycznych) stosu|« n, t liii ality dienolil, który może być łatwo otrzymany przez połączenie aeliuahiego du nobla z cząsteczką chiralnego pomocnika. Przykładem takiego ro/wia/.im i |> i u.ycii chiralnego estru kwasu fumarowego. Fu-
15
HOMO (1)
LUMO (15)
|h ki I )ielsa-Aldera jest przykładem reakcji pericyklicznej, zachodzącej ">\Vv '"'cni symetrii orbitali (reguły Woodwarda-Hoffmanna). Stan przej-1 '1 !VI< > ^Cj‘ PowstaJe Przez oddziaływanie HOMO jednego z reagentów •iją | ' l,(>zostałego reagenta (nakładające się orbitale układu reakcyjnego
Si||n znak (schemat 1.1.8).
Wyszukiwarka
Podobne podstrony:
S0009 (2) I Solnktywiii) tworzonio wigzań węgiel węgiel O O COOR 1
49836 S0009 (2) I Solnktywiii) tworzonio wigzań węgiel węgiel O O COOR 1
S0014 (2) I. Solni*.tywno tworzonie wiązań węgiel węgiel kontrola kinetyczna kontrola
S0020 (3) I Solnktywiut twor/.onio wiązań węgiel wygml O© u i :i o()(’( i iP(OEt), + o / K H R O II
77564 S0020 (3) I Solnktywiut twor/.onio wiązań węgiel wygml O© u i :i o()(’( i iP(OEt), + o / K H R
węgiel, pak węglowy lub materiały syntetyczne takie jak polimery. Porowata struktura węgla jest wytw
• Węgiel Brunatny • Wiadomości Chemiczne •
więcej podobnych podstron