S0014 (2)
I. Solni*.tywno tworzonie wiązań węgiel węgiel
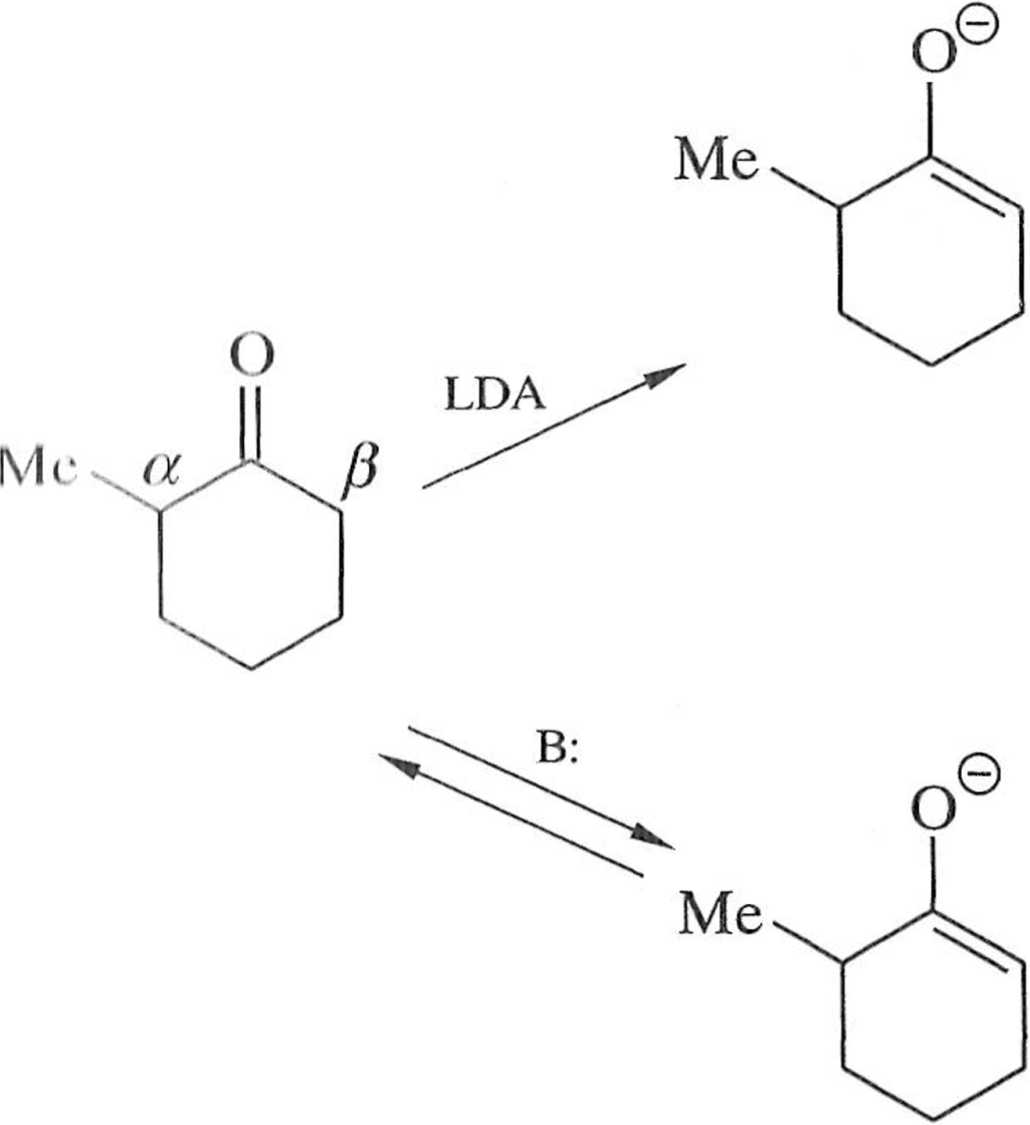
kontrola kinetyczna
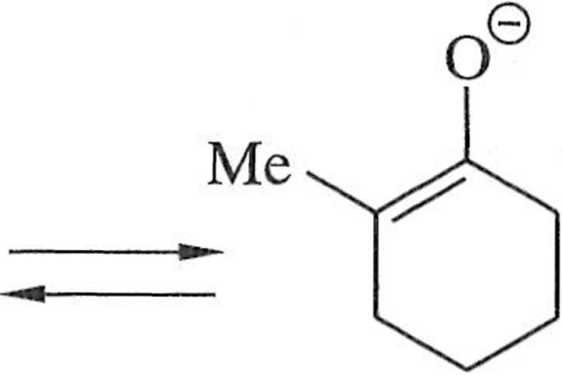
kontrola termodynamiczna
produkt
trwalszy
Schemat 1.2.4
enolan winien być bezzwłocznie poddany reakcji ze związkiem karbonylowym. Trwalszy enolan powstaje w warunkach kontroli termodynamicznej, gdy do roz-Iworu ketonu dodawana jest zasada. W roztworze ustala się równowaga między ketonem i utworzonymi enolanami iw efekcie dominuje enolan trwalszy, bardziej podstawiony.
Regioselektywność reakcji aldolowej można zwiększyć przez dodatek stechio-metrycznych ilości kwasu Lewisa. W warunkach kontroli termodynamicznej, przy współudziale chlorku tytanu(IV), Mahrwald i Giindogan otrzymali z wysoką re-gioselektywnością szereg aldoli podstawionych od strony bardziej zatłoczonej (strona a ketonu użytego do generowania enolanu) (schemat 1.2.5) [7].
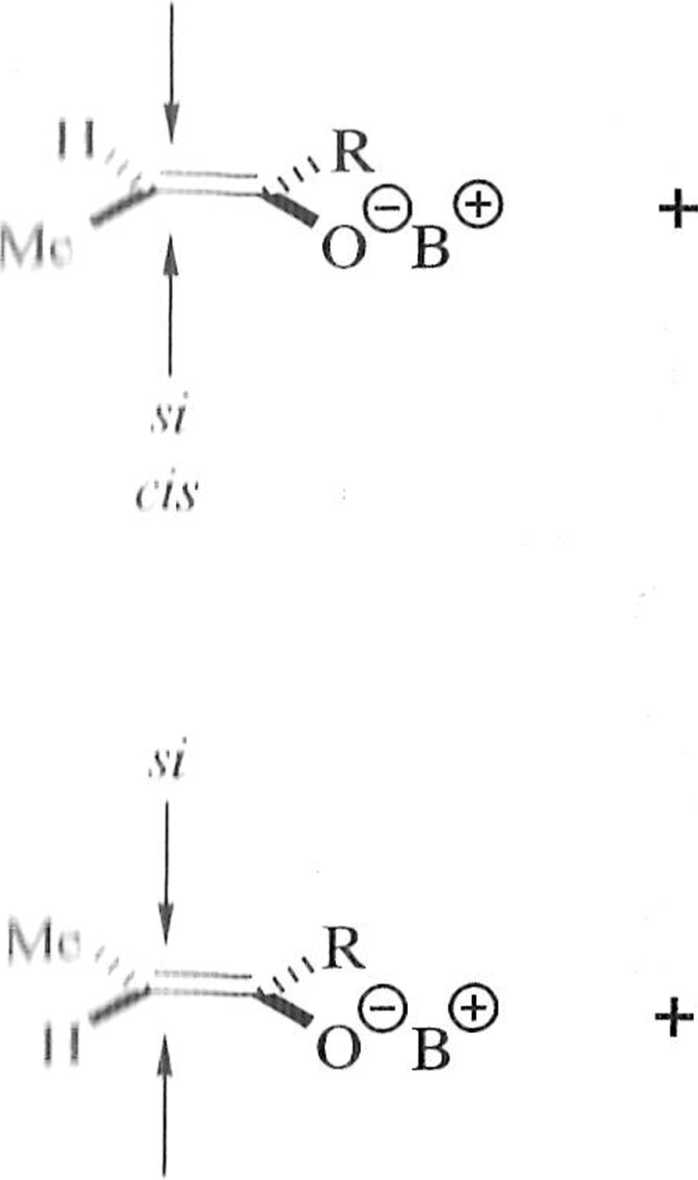
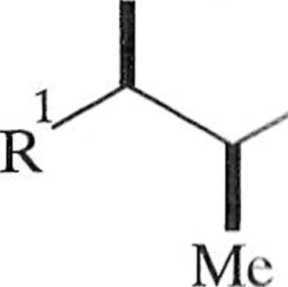
Reakcja zachodzi w sposób diastereoselektywny, a produktem otrzymywanym w przewadze jest yyn-aldol 9. Diastereoselektywność tego typu (diastereose-Icklywność prosta) związana jest z podejściem odpowiedniego lica aldehydu do odpowiedniego lica enolanu. Diastereoselektywność prosta jest zależna zwłaszcza od konfiguracji enolanu, obecności chelatującego jonu, warunków prowadzenia procesu i innych [6]. Zależność między geometrią enolanu i strukturą aldolu jest przedstawiona na schemacie 1.2.6. Warto dodać, że z có-enolanu otrzymywane są w przewadze syn-aldole, a z tra/w-enolanów — aldole o konfiguracji anti*
Szersze omówienie zależności między strukturą substratów i produktów znajdzie Czytelnik w literaturze źródłowej [8].
A
Należy dodać, że w tym przypadku c/.s-enolan ma konfigurację Z, a trans enolan konfigurację !C.
o o on on o
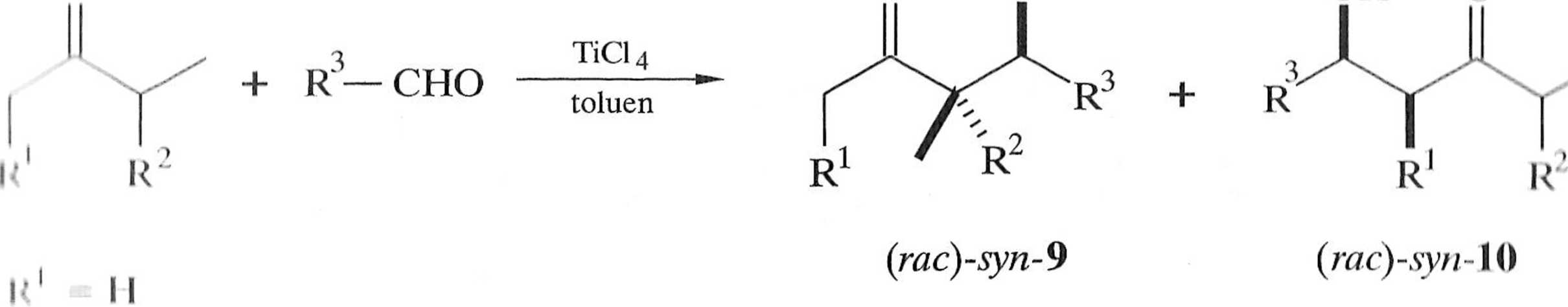
!; M, Me, /7-Bu, Ph |.'i.K'--(CH2)2- -(CH2)3-l<' //-Pr, /-Pr, Ph
Schemat 1.2.5
re
rc
rr
trans
H//( *
\*>=o
R i
re +lub si + re
0°B® ()
>yy//
l{
re + re
57
re
re + /‘e lub sz + si
H/„ ' R1*" i

O
'/
S7
O0B® ()
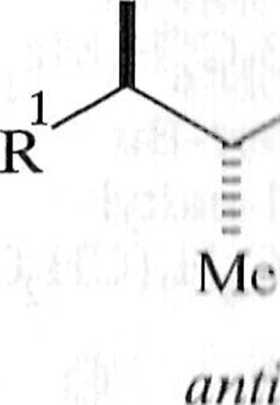
Schemat 1.2.6
Reakcja diastereoselektywna w wersji asymetrycznej związana jest z obecno 11.) centrum chiralności w jednym z substratów. Często centrum chiralności |>o . liodzi od celowo wprowadzonego pomocnika chiralnego. Prostym przykładem la I icgo chiralnego pomocnika jest efedryna (11) i jej cykliczna pochodna 12 |b-l 11.
Reakcja chiralnego propionoamidu 13 z aldehydami prowadzi do aldoli wn 15 o wysokim nadmiarze diastereo- i enancjomerycznym (schemat 1.2.7). I Masteicoselcktywność związana jest z obecnością grupy metylowej połączonej alomem azolu i 1,2-diplanai na konformacją chiralnego pomocnika. Zc względu u.i silne oddziaływanie sleiyc/uc z podstawnikiem acylowym grupa melylowa
Wyszukiwarka
Podobne podstrony:
S0009 (2) I Solnktywiii) tworzonio wigzań węgiel węgiel O O COOR 1
S0017 (3) I SoloMywno łworzonio wiązań węgiel węgiel Tabela 1.2.1. Sub,straty i produkty reakcji ald
S0031 (2) I SoloklywMM twor/onio wiązań węgiel węgiel N, N
S0041 (2) I. Selektywne tworzenie wiązań węgiel-węgiol u) [Mo] + + ■Ht, tłialkenowy proces
37444 S0030 (2) TMMnlam I Suloklywno tworzenie wiązań węgiel-węgiel Tabela 1.5.1. Synteza estrów all
S0009 (2) I Solnktywiii) tworzonio wigzań węgiel węgiel O O COOR 1
S0017 (3) I SoloMywno łworzonio wiązań węgiel węgiel Tabela 1.2.1. Sub,straty i produkty reakcji ald
S0020 (3) I Solnktywiut twor/.onio wiązań węgiel wygml O© u i :i o()(’( i iP(OEt), + o / K H R O II
S0023 (2) I Selektywna tworzenie wiązań węgiel węgiel (4) 2 ( ) + Ph Nil, A />-TsOH Me toluen,
S0027 (2) I Sfilnktywno tworzenie wiązań węgiel węgiel i hiralnego pomocnika związanego kowalencyjni
więcej podobnych podstron